Absorção (química)
Absorção na química é um fenômeno ou processo físico ou químico em que átomos, moléculas ou íons introduzem-se em alguma outra fase, normalmente mais massiva, e fixam-se. O processo pode se dar pela fixação de um gás por um sólido ou um líquido, ou a fixação de um líquido por um sólido.
A substância absorvida se infiltra na substância que absorve, diferentemente da adsorção, já que espécies químicas submetidas a absorção são absorvidas pelo volume, não pela superfície (como no caso de adsorção). Um termo mais geral é sorção que abrange adsorção e troca iônica. A absorção é basicamente quando algo toma lugar em outra substância.[1]
Trata-se de uma operação unitária e está limitada as restrições termodinâmicas assim como a destilação portanto o conhecimento em termodinâmica é imprescindível para se projetar ou operar uma coluna de absorção.
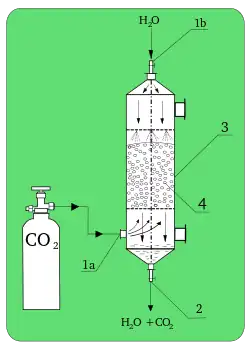
Considere um soluto na forma de vapor, por exemplo, amônia, misturado com um gás, a ser chamado de "inerte" por exemplo, ar. Esse nome de inerte deve-se a que ele permanecerá sempre na fase gasosa, não será transportado. Deseja-se remover o soluto da mistura gasosa ou para reaproveitamento ou para evitar que essa mistura ar+amônia seja lançada na atmosfera. A remoção completa é impossível, pode se chegar a 99,99% de recuperação mas nunca 100%.
A retirada do soluto (amônia) será feita através de um solvente, por exemplo, água ou um "reagente químico" (por exemplo, uma solução ácida). No primeiro caso, a remoção dá-se através da solubilidade da amônia na água; no outro caso, a amônia reage com o ácido (reação química, um processo químico). Dependendo do caso, um ou outro método pode ser mais interessante e econômico. Para o exemplo em questão, a absorção física é a mais recomendada, pois a água é um ótimo solvente para a amônia; é barata, não é tóxica, não é tão volátil, não é corrosiva, não é viscosa, nem inflamável e é quimicamente estável.
Uma outra simplificação, muitas vezes adotada, é considerar que a água também seja inerte, isto é, ela permanece na forma de líquido e praticamente não evapora. Essa simplificação, em geral, é aceitável porque a quantidade de água evaporada, quando ocorre, normalmente é desprezível em relação à quantidade de soluto que é absorvido. Assim, temos um inerte no gás (ar) e um inerte no líquido (água), e o único componente que passa de uma fase à outra é a amônia.
Em termos de aplicações industriais, pode-se citar diversos exemplos de absorção, tais como na purificação de gases de combustão, remoção de CO2 na fabricação de amônia, recuperação de solutos (SO2, acetona, HCl, etc.) em processos diversos. A absorção de gases é fundamental no processo de contato, na produção de ácido sulfúrico.
Lei da partição de Nernst
Se a absorção é um processo físico não acompanhado por qualquer outro processo físico ou químico, ele normalmente segue a lei da partição de Nernst:
- "a razão de concentrações de algumas espécies de solutos em duas fases volumosas em contato é constante pra um dado soluto de fases volumosas";[2]
O valor da constante KN depende da temperatura e é chamado coeficiente de partição. Esta equação é valida se concentrações não são muito grandes e se as espécies "x" não alteram sua forma em qualquer das duas fases "1" ou "2". Se tais moléculas sofrem associação ou dissociação então esta equação ainda descreve o equilíbrio entre "x" em ambas as fases, mas somente para a mesma forma - as concentrações de todas as formas restantes devem ser calculadas tendo em conta todos os equilíbrios das outras.[1]
No caso da absorção de gases, pode-se calcular sua concentração usando-se, e.g., a lei dos gases ideais, . Alternativamente, pode-se usar pressões parciais em vez de concentrações.
Em muitos processos tecnologicamente importantes, a absorção química é usada no lugar do processo físico, e.g., a absorção de dióxido de carbono por hidróxido de sódio ou hidróxido de lítio (preferido em respiradores para uso em missões espaciais) - tais processos não seguem a lei da partição de Nernst.
Para alguns exemplos deste efeito ver extração líquido-líquido, é possível extrair de uma fase líquida a outra um soluto sem uma reação química. Exemplos de tais solutos são os gases nobres e o tetróxido de ósmio.[1]
Referências
- McMurry, John (2003). Fundamentals of Organic Chemistry Fifth ed. [S.l.]: Agnus McDonald. 409 páginas. ISBN 0534395732
- Adam W. Marczewski; Adsorption GLOSSARY (em inglês)
- R. B. Bird, W. E. Stewart, E. N. Lightfoot, "Transport Phenomena", John Wiley & Sons, Inc., New York, 1969.
- A. Foust et al., "Principles of Unit Operations", 2nd ed., Jonh Wiley and Sons, N.Y., 1980.
Ligações externas
- Absorção - Fundamentos - labvirtual.eq.uc.pt