Cloreto de vanádio(II)
Cloreto de vanádio(II) é um composto inorgânico de fórmula química VCl2. É o composto menos oxidado dentre os cloretos desse metal. É um composto sólido verde à temperatura ambiente e se dissolve em água formando uma solução roxa. [1]
| Cloreto de vanádio(II) Alerta sobre risco à saúde | |
|---|---|
 | |
| Nome IUPAC | Cloreto de vanádio(II) |
| Outros nomes | Cloreto vanadoso |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| Número RTECS | YW1575000 |
| SMILES |
|
| InChI | 1/2ClH.V/h2*1H;/q;;+2/p-2 |
| Propriedades | |
| Fórmula molecular | VCl2 |
| Massa molar | 121.847 g/mol |
| Aparência | pale green solid |
| Densidade | 3.230 g/cm3 |
| Ponto de fusão |
1027 °C, 1300 K, 1881 °F |
| Ponto de ebulição |
1506 °C, 1779 K, 2743 °F |
| Solubilidade em água | soluble |
| Estrutura | |
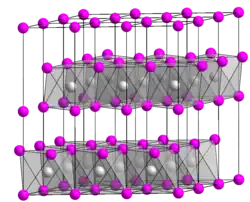
| Estrutura cristalina | CdI2 |
| Geometria de coordenação |
octahedral |
| Riscos associados | |
| Principais riscos associados |
Reacts with oxygen rapidly |
| Frases R | 20/21/22-34 |
| Frases S | 26-27-36/37/39-45 |
| Compostos relacionados | |
| Outros aniões/ânions | Fluoreto de vanádio(II), Brometo de vanádio(II), Iodeto de vanádio(II) |
| Outros catiões/cátions | Cloreto de titânio(II), Cloreto de crômio(II) |
| Compostos relacionados | Cloreto de cádmio(III) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Preparação, propriedades, e compostos relacionados
VCl2 sólido é obtido pela decomposição térmica do VCl3, que forma como resídou o VCl2:[1]
- 2 VCl3 → VCl2 + VCl4
VCl2 se dissolve em áqua formando o complexo iônico aquoso roxo [V(H2O)6]2+. Evaporação dessa solução produz cristais de [V(H2O)6]Cl2.[2]
Estrutura
O VCl2 sólido adota a estrutura do iodeto de cádmio, formando uma geometria de coordenação octaédrica. VBr2 e VI2 são estruturalmente e quimicamente similares ao dicloreto. Todos possuem configuração d3 , com um quarteto no estado fundamental, semelhante ao Cr(III).[3]
Referências
- Young, R. C.; Smith, M. E. "Vanadium(II) Chloride" Inorganic Syntheses, 1953, volume IV, page 126-127.doi:10.1002/9780470132357.ch42
- Martin Pomerantz, Gerald L. Combs, N. L. Dassanayake, "Vanadium Dichloride Solution" Inorganic Syntheses, 1982, vol. XXI, pp. 185–187. doi:10.1002/9780470132524.ch42
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.