Energia reticular
A energia reticular ou energia de malha[1] é definida como a energia necessária para transformar um mol de íons de um sólido iónico em íons gasosos, separados por uma distância infinita. Também pode ser definida como a energia liberada no processo inverso, isto é, na combinação de íons gasosos para formar um sólido cristalino. A energia de rede geralmente é medida em quilojoule por mol. Para cada sólido em particular, a energia da rede é uma constante que mede o quão firmemente as partículas constituintes são mantidas juntas.[2]
Equação de Born-Landé
A equação de Born-Landé, proposta por Max Born e Alfred Landé, fornece o valor da energia reticular de um composto iônico.[3][4] A energia pode ser calculada com recurso a fórmula:
Sendo,
, a constante de Avogadro;
, a constante de Madelung, relativa à geometria do cristal;
, o número de carga do cátion;
, o número de carga do ânion;
, a carga do elétron, de valor 1.6022×10−19 C;
, a constante de permitividade eléctrica 8.854×10−12 C^2 J^−1 m^−1;
, a distância ao íon mais próximo; e
, o expoente de Born.
A equação de Born-Landé demonstra que a energia da rede de um composto aumenta conforme o aumento da carga e a proximidade dos íons.
Ciclo de Born-Haber
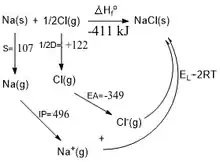
O ciclo de Born-Haber é uma aplicação da Lei de Hess para calcular a entalpia reticular de um composto iônico.[5]
Exemplo
A energia associada a formação do Cloreto de sódio pode ser medida em etapas.[6] Pela Lei de Hess:
Onde,
é a entalpia padrão de formação do sólido iônico. Corresponde a energia liberada ou consumida na formação de 1 mol da substância a partir de substâncias simples no estado padrão (estado físico e alotrópico mais estável a 298 K e pressão de 1 atm);
é a entalpia de sublimação do sódio;
é a energia de dissociação de 1 mol de moléculas de cloro na forma gasosa;
é a entalpia associada ao potencial de ionização do sódio;
é a entalpia associada a afinidade eletrônica do cloro;
é a entalpia de rede.
Com exceção da entalpia de rede, todos os outros valores são obtidos experimentalmente.
Referências
- Silva, Carlos J. R. (1996). «Preparação e caracterização de electrólitos poliméricos». RepositoriUM. Consultado em 8 de junho de 2020
- «Energia reticular». Encyclopædia Britannica Online (em inglês). Consultado em 1 de janeiro de 2020
- BROWN, I. D.. The chemical Bond in Inorganic Chemistry, IUCr monographs in crystallography, Londres: Oxford University Press, 2002, ISBN 0-19-850870-0
- David Arthur Johnson, Metals and Chemical Change,Open University, Royal Society of Chemistry, 2002,ISBN 0-85404-665-8
- «Ciclo de Born-Haber - Química». InfoEscola. Consultado em 18 de fevereiro de 2021
- «Aula 1». www.profpc.com.br. Consultado em 18 de fevereiro de 2021