Dispersão de Rutherford
Em física, a dispersão de Rutherford é um fenômeno que foi explicado por Ernest Rutherford em 1909,[1] e levou ao desenvolvimento da teoria orbital do átomo. É agora explorado pela técnica de análise de materiais espectrometria de dispersão de Rutherford. A dispersão de Rutherford é também referida às vezes como dispersão de Coulomb porque baseia-se em forças eletrostáticas (Coulomb). Um processo similar provou o interior do núcleo nos anos 1960, chamado dispersão profunda inelástica.
Destaques da experiência de Rutherford
- Um feixe de partículas alfa é direcionado a uma folha de ouro fina.
- Muitas das partículas passaram através da película sem sofrer desvio.
- Outras foram desviadas por diversos ângulos.
- Algumas inverteram o sentido do movimento.
A partir destes resultados, Rutherford concluiu que a maioria da massa era concentrada numa região minúscula, positivamente carregada (o núcleo), rodeada por electrões. Quando uma partícula alfa (positiva) se aproximava o suficiente do núcleo, era fortemente repelida.[2] O pequeno tamanho do núcleo explicou a pequena quantidade de partículas alfa que foram repelidas em ângulos maiores. Rutherford demonstrou usando o método abaixo, que o tamanho do núcleo era inferior do que cerca de
Teoria de Dispersão
Principais pressupostos:
• Colisão entre uma carga pontual, mais um núcleo pesado com carga Q=Ze é um projétil leve com carga q=ze é considerada como sendo elástica.
• Momento e energia são conservados.
• As partículas interagem através da força de Coulomb.
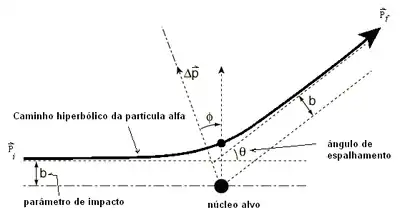
• A distância vertical onde o projétil se encontra a partir do centro do alvo, o parâmetro de impacto b , determinam o ângulo de dispersão θ.
A relação entre o ângulo de dispersão θ, a energia cinética inicial
e o parâmetro de impacto b é dado pela relação
(1,1)
onde z = 2, para partículas-α e Z = 79 de ouro.
Dedução da Transversal Diferencial
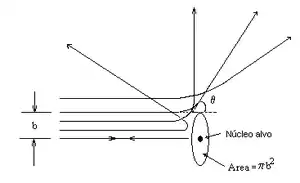
Na Figura , uma partícula que atinge o anel entre b e b + db é desviada num ângulo sólido dΩ entre θ e θ + dθ.
Por definição, a secção transversal é a constante de proporcionalidade
então
(1,2)
onde
A seção transversal diferencial torna-se então
(1,3)
A partir da Equações 1,1 e 1,3 nós temos
(1.4)
A Eq.1.4, é chamada seção transversal diferencial para a dispersão de Rutherford.
Nos cálculos acima, considera-se apenas uma única partícula alfa. Num experimento de dispersão, é preciso considerar vários eventos de dispersão e medir-se a fracção de partículas desviadas num determinado ângulo.
Para um detector em um ângulo específico em relação ao feixe incidente, o número de partículas por unidade de superfície, colidindo o detector, é dado pela fórmula de Rutherford:
Onde:
Ni = número de partículas alfa incidentes;
n = átomos por unidade de volume no alvo;
L = espessura do alvo;
Z = número atómico do alvo;
e = carga electrónica;
k = constante de Coulomb;
r = distância entre o alvo e o detector;
KE = energia cinética das partículas alfa;
θ = ângulo de dispersão.
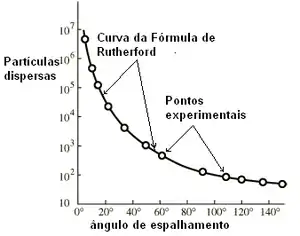
A variação prevista, de partículas alfa detectadas, com ângulo é seguida de perto podados do contador de Geiger-Marsden, mostrados na Figura abaixo.
Cálculo do tamanho nuclear máximo
Para colisões frontais cabeças entre partículas alfa e o núcleo, toda a energia cinética da partícula alfa é transformada em energia potencial e a partícula está em repouso.
A distância entre o centro da partícula alfa e o centro do núcleo (b) neste momento é um valor máximo para o raio, se é evidente a partir da experiência que as partículas não atingiram o núcleo.
Aplicando a energia potencial de Coulomb entre as cargas nos electrões e no núcleo, pode-se escrever:
Reorganizando,
(1,6)
Para uma partícula alfa:
Substituindo estes valores na eqn.1,6, dá o valor do parâmetro de impacto de cerca de .
O verdadeiro raio é cerca de .
Ver também
Referências
- E. Rutherford, "The Scattering of α and β Particles by Matter and the Structure of the Atom", Philos. Mag., vol 6, pp.21, 1909
- KIWANGA, Christopher Amelye (2013). Christopher Amelye. KIWANGA, ed. Física Nuclear. Introdução à Física Nuclear. 1 1 ed. Reino Unido: [s.n.] 133 páginas. Consultado em 20 de agosto de 2013. Arquivado do original em 10 de janeiro de 2014
Bibliografia
- E. Rutherford, The Scattering of α and β Particles by Matter and the Structure of the Atom, Philosophical Magazine. Séries 6, vol. 21. maio 1911
- H. Geiger and E. Marsden, On a Diffuse Reflection of the α-Particles, Proceedings of the Royal Society, 1909 A vol. 82, p. 495-500