Ligação de valência
Em química, a teoria da ligação de valência tenta explicar a formação de ligações covalentes.[1]
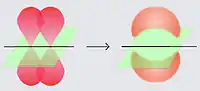
O modelo da teoria de ligação de valência
De acordo com a teoria de ligação de valência (TLV), a ligação entre dois átomos é conseguida através da sobreposição de dois orbitais atômicos semipreenchidos. Sobreposição refere-se a uma porção destes orbitais atômicos que ocupam o mesmo espaço.
Nesta zona de sobreposição, existe apenas um par de elétrons com spins desemparelhados, provocando a aproximação dos núcleos e diminuindo a energia potencial do sistema.
Logo, os átomos tendem a posicionar-se de forma a que a sobreposição de orbitais seja máxima, reduzindo a energia do sistema a um mínimo, formando ligações mais fortes e estáveis.
Orbitais σ
Quando o emparelhamento se dá através de orbitais segundo o eixo de ligação dos átomos, as ligações denominam-se σ . As orbitais que geralmente formam ligações σ são as s e p.
Orbitais π
Quando o emparelhamento se dá através de orbitais fora do eixo de ligação dos átomos, as ligações denominam-se π. Os orbitais que geralmente formam ligações π são as px e py
Exemplos
O2
A configuração electrônica do oxigênio é 1s2 2s2 2px2 2py1 2pz1.
Então cada átomo de O do dioxigênio possui dois elétrons desemparelhados (2py1 e 2pz1). Sobrepondo os orbitais 2pz de cada átomo, forma-se uma ligação σ; sobrepondo as orbitais 2py de cada átomo, forma-se uma ligação π.
Assim, forma-se uma ligação covalente dupla entre os átomos, composta por uma ligação σ e uma π.
N2
A configuração eletrônica do nitrogênio é 1s2 2s2 2px1 2py1 2pz1.
No caso do dinitrogênio, cada átomo de N possui três elétrons 2p desemparelhados (2px1, 2py1 e 2pz1). Sobrepondo os orbitais 2pz de cada átomo forma-se uma ligação σ e sobrepondo os orbitais 2px e 2py, formam-se duas ligações π.
Assim, forma-se uma ligação covalente tripla entre os átomos, composta por uma ligação σ e duas π.
Hibridização de orbitais
Metano (CH4)
A configuração eletrônica do carbono é 1s2 2s2 2px1 2py1 2pz0
Logo, parece que o carbono apenas pode estabelecer duas ligações. Então como se pode ligar a 4 átomos de hidrogénio?
Primeiro, é necessário promover um eletron 2s a 2p, ficando com uma configuração semelhante à seguinte: 1s2 2s1 2px1 2py1 2pz1.
Agora, já podemos considerar que cada um destes elétrons desemparelhados se une ao único elétron 1s do hidrogênio, formando 4 ligações σ. Uma das ligações seria resultante da sobreposição da orbital 1s do hidrogénio com a 2s do carbono; e as restantes 3 resultantes da sobreposiçaõ das orbitais 1s com as 2p. Daqui se deduziria que a geometria desta molécula seria a de 3 ligações segundo os eixos ortogonais e uma no espaço restante. No entanto, dados experimentais sugerem que todas as ligações são iguais, e distanciadas igualmente, formando ângulos de 109,5º entre si.
Daqui surge a ideia de hibridização das orbitais. O que isto significa é que em vez de orbitais s e p, apenas existem 4 orbitais híbridas sp3, todas iguais em termos energéticos.
Etino (C2H2)
Considerando o carbono excitado: 1s2 2s1 2px1 2py1 2pz1; nesta molécula também se dá hibridização de orbitais, mas apenas de duas, da orbital s e de uma p, formando duas orbitais híbridas sp.
Uma dessas orbitais sp vai-se ligar à orbital 1s do hidrogénio (ligação σ), enquanto que a outra orbital sp se liga a outra híbrida sp do outro átomo de carbono (ligação σ). As orbitais 2p restantes ligam-se com as outras orbitais 2p do outro carbono, formando duas ligações π. Assim se explica a ligação tripla entre os átomos de carbono, sendo esta constituída por uma ligação σ e duas π.
Eteno (C2H4)
No eteno, em que há uma ligação dupla entre os átomos de carbono, podemos concluir que se formam 3 orbitais híbridas sp2, em que duas delas se ligam com as orbitais 1s dos hidrogénios(ligação σ); a restante a veiA liga-se á orbital sp2 do outro carbono (ligação σ); e a orbital 2p restante liga-se à outra orbital 2p, formando uma ligação π.
As fragilidades da teoria
Esta teoria de ligação química, no seu formato original, é acusada de não ser capaz de explicar a forma de algumas moléculas, os ângulos de ligação das moléculas, o papel do par electrónico nas ligações, e as propriedades de algumas moléculas, como o paramagnetismo. Versões modernas da teoria de valência, tal como o "Spin Coupled" (SCVB) consegue descrever adequadamente esses fenômenos químicos.
Bibliografia
- Química Geral 1 e reações químicas (John C. Kotz e Paul M. Treichel, Jr)
- Química Inorgânica, Shiriver & Atkins
Referências
- «Ligação de valência». Encyclopædia Britannica Online (em inglês). Consultado em 12 de dezembro de 2019