Reação dе Hajos–Parrish–Eder–Sauer–Wiechert
A reação de Hajos–Parrish–Eder–Sauer–Wiechert em química orgânica é uma reação aldólica assimétrica catalisada de prolina. A reação é nomeada devido ao trabalho de seus principais pesquisadores, Zoltan Hajos e outros, da Hoffmann-La Roche[1][2] e Schering AG.[3] Descoberta nos anos 1970 o procedimento catalítico original de Hajos-Parrish - mostrado na equação de reação - levando ao cetol bicíclico opticamente ativo, assim como a modificação Eder-Sauer-Wiechert, levando a opticamente ativa enediona através da perda de água do cetol pavimentou o caminho da organocatálise assimétrica. Tem sido usada extensivamente como uma ferramenta na síntese de esteroides e outras moléculas enantiomericamente puras.[4]
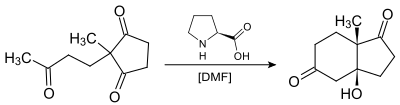 Figura 1: A reação original.
Figura 1: A reação original.
Na reação original mostrada na Figura 1. prolina quiral ocorrendo naturalmente é o catalisador quiral numa reação aldólica. O material de partida é uma tricetona aquiral e requer apenas 3% de prolina para obter o produto de reação, um cetol em 93% excesso enantiomérico. Como mostrado acima, Hajos e Parrish trabalharam a temperatura ambiente em dimetilformamida (DMF) solvente usando uma quantidade catalítica (3% molar equiv.) de (S)-(−)-prolina permitindo isolar o intermediário cetol bicíclico opticamente ativo. Assim, eles descreveram o primeiro uso de prolina em uma reação aldólica catalítica assimétrica.
O grupo de Schering trabalhou sob condições não biológicas usando (S)-prolina (47 mol%), ácido perclórico 1 N, em acetonitrila a 80 °C. Portanto, eles não podiam isolar o intermediário Hajos-Parrish cetol bicíclico mas sim o produto de condensação (S)-7a-metil-2,3,7,7a-tetraidro-1H-indeno-1,5(6H)-diona através da perda de água.[5] Trinta e sete anos depois [6] um novo grupo na Schering AG publicou a continuação do trabalho anterior de Schering. [3] Em vez das condições não biológicas acima mencionadas, o novo grupo usou o procedimento catalítico de Hajos-Parrish. Assim, eles poderiam isolar o cetol 6,5-bicíclico opticamente ativo descrito até então apenas nas publicações de Hajos-Parrish.[1][2]
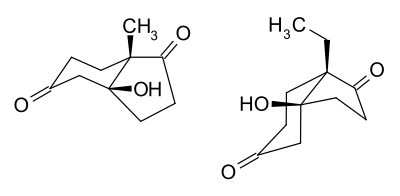
Hajos e Parrish investigou ainda mais a configuração exata do acima cis-fundido-7a-metil- 6,5-bicíclico-cetol por dicroísmo circular, e estes resultados foram confirmados por um estudo de difração de raio X de cristal único. O centro simétrico do cristal do cetol racêmico correspondente em um átomo pesado marcador tem sido obtido pelo uso de prolina racêmica. Mostra-se por difração de raios X uma orientação axial do grupo metilo angular e uma orientação equatorial do grupo hidroxilo no confórmero cadeira do anel de seis membros. Isto está em concordância com a estrutura cristalina do anel CD da digitoxigenina.[7] A estrutura deste cetol e seu homólogo etil são mostrados como segue:
Estudos similares do homólogo 7a-etil mostraram que o etil cetol bicíclico existe em uma conformação cis na qual o grupo 7a-etil grupo é orientado equatorialmente e o grupo hidroxilo é orientado axialmente na forma cadeira do anel de seis membros como mostrado acima. O motivo de uma preferência por esta conformação poderia ser interação 1,3-diaxial melhorado no outro confórmero cis entre o grupo etilo angular e os hidrogênios axiais no C-4 e C-6 no anel de seis membros.
Referências
- Z. G. Hajos, D. R. Parrish, German Patent DE 2102623 1971
- Asymmetric synthesis of bicyclic intermediates of natural product chemistry Zoltan G. Hajos, David R. Parrish J. Org. Chem.; 1974; 39(12); 1615-1621. doi:10.1021/jo00925a003
- New Type of Asymmetric Cyclization to Optically Active Steroid CD Partial Structures Angewandte Chemie International Edition in English Volume 10, Issue 7, Date: July 1971, Pages: 496-497 Ulrich Eder, Gerhard Sauer, Rudolf Wiechert doi:10.1002/anie.197104961
- Zerong Wang in Comprehensive Organic Name Reactions and Reagents, 3V Set, p. 1306, John Wiley and Sons Inc. 2009.
- Proline-catalyzed asymmetric reactions Tetrahedron Report Number 10450 Tetrahedron Volume 58, Issue 28, 8 July 2002, Pages 5573-5590 Benjamin List doi:10.1016/S0040-4020(02)00516-1
- J.Org.Chem.,2008, 73, 5151-5154
- The crystal structure of digitoxigenin C23H34O4, Karle, I.L., and Karle, J., Acta Crystallogr. B, 25: 434-442 (1969).