Reação de Wolff-Kischner
Na química orgânica, a síntese de Wolff-Kischner é o nome que se dá à reação que torna possível a conversão de uma cetona em um grupo CH2 usando hidrazina com um tratamento em meio básico (soda):
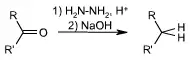
Mecanismo
A hidrazina é um nucleófilo (grupo contendo pares eletrônicos livres, capaz de doá-los para estruturas deficientes de elétrons), forte o suficiente para promover ataques nucleofílicos em carbonilas de cetonas. Tal ataque, seguido de uma troca protônica e da eliminação de hidroxila, dá origem a uma hidrazona (composto orgânico contendo um carbono ligado, duplamente a um nitrogênio e, este, a um grupo -NH2). O tratamento deste composto com uma solução aquosa de base forte, como hidróxido de sódio ou potássio, provoca a eliminação de nitrogênio gasoso e gera um grupo metileno (-CH2-) onde existia a carbonila cetônica, como mostra o mecanismo:
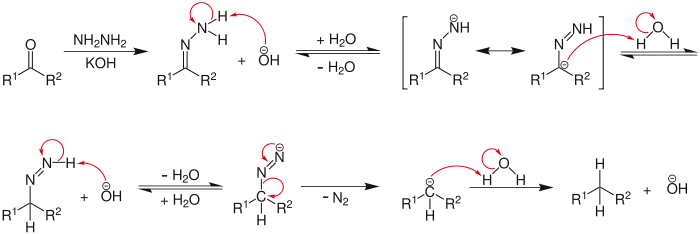
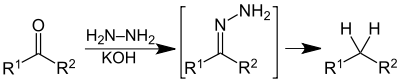
A representação usada para o carbono da carbonila após a inserção do primeiro hidrogênio não indica estereosseletividade, apenas mostra que houve a inserção de próton naquela posição. O mecanismo pode ser simplificado, exibindo-se apenas as perdas significativas durante a reação, através da ilustração dos reagentes, da hidrazona formada e do produto final:
Por não se usar de meio ácido, como a Redução de Clemmensen, a reação de Wolff-Kishner pode ser usada para cetonas contendo grupos hidroxílicos nas cadeias laterais (representadas no mecanismo por R' e R") sem que ocorra reações de eliminação para gerar alcenos. Tais reações são especialmente importantes em sistemas cetônicos contendo hidroxilas β à carbonila, que eliminam facilmente o grupo alcoólico para gerar uma estrutura α, β insaturada:
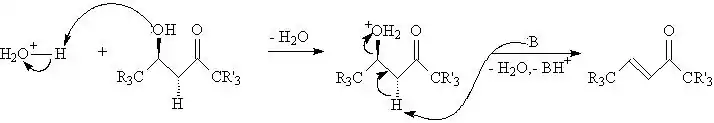
Na representação acima, R3 e R'3 indicam que os carbonos possuem grupos substituintes. O composto "B" é apenas um aceptor de prótons capaz de extrair o hidrogênio do grupo metileno (-CH2-) entre a carbonila e o álcool protonado. O grande caráter ácido dos hidrogênios no carbono localizado entre a cetona e o álcool faz com que a desidratação seja favorecida. A formação de um sistema insaturado conjugado também favorece a reação acima. A reação de Wolff-Kishner ainda é útil em outros sistemas passíveis de decomposição por ácidos, mas resistentes a hiróxidos fortes.
Referências
- Kishner, N.J. Russ. Phys. Chem. Soc., 43, 582 (1911).
- Wolff, L. Ann., 1912, 394, 86.