Ácido arsenioso
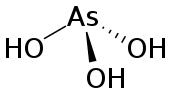
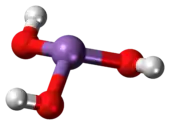
Ácido arsenioso é um composto orgânico com a fórmula H3AsO3. É conhecido por ocorrer em soluções aquosas, mas não foi isolado na forma de um material puro, embora este facto não diminua a importância de As(OH)3.[1]
| Arsenous acid Alerta sobre risco à saúde | |
|---|---|
 | |
 | |
| Nome IUPAC | Arsorous acid |
| Outros nomes | Arsenious acid Arsenic oxide |
| Identificadores | |
| Número CAS | |
| PubChem | |
| DrugBank | DB04456 |
| ChemSpider | |
| ChEBI | |
| SMILES |
|
| InChI | 1/AsH3O3/c2-1(3)4/h2-4H |
| Propriedades | |
| Fórmula molecular | H3AsO3 |
| Massa molar | 125.94 g/mol |
| Aparência | Only exists in aqueous solutions |
| Riscos associados | |
| Principais riscos associados |
Toxic, corrosive |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Propriedades
As(OH)3 é uma molécula que consiste em três grupos piramidais hidroxila ligados ao arsénio. O espectro 1H RMN de soluções de ácido arsenioso consiste em um único sinal consistente com a elevada simetria da molécula.[2] Em contraste, a nominalmente relacionada às espécies do fósforo H3PO3 adota essencialmente a estrutura HPO (OH)2; P(OH)3 é um componente de equilíbrio muito menor de tais soluções. Os diferentes comportamentos dos compostos de P e reflectem uma tendência em que os estados de oxidação elevados são mais estáveis para os membros mais leves das principais elementos do grupo do que os seus congéneres mais pesados.[3]
Reações
A preparação de As(OH)3 envolve uma lenta hidrólise de trióxido de arsênio em água. A adição de base de conversão do ácido arsenioso para os iões arsenito [AsO3]3-. O primeiro pKa é de 9,2, por isso As(OH)3 é um ácido fraco.[3] Reações atribuídas à solução aquosa de trióxido de arsênio são devidos ao ácido arsenioso e as suas bases conjugadas.
Toxicologia
Compostos com arsênico são altamente tóxicos e cancerígenos. O anidrido forma de ácido arsenioso, trióxido de arsênio, é utilizado como herbicida, pesticida e raticida.
Referências
- Munoz-Hernandez, M.-A. (1994). «Arsenic: Inorganic Chemistry». In: King, R. B. Encyclopedia of Inorganic Chemistry. Chichester: John Wiley & Sons
- Kolozsi, A.; Lakatos, A.; Galbács, G.; Madsen, A. Ø.; Larsen, E.; Gyurcsik, B. (2008). «A pH-Metric, UV, NMR, and X-ray Crystallographic Study on Arsenous Acid Reacting with Dithioerythritol» (PDF). Inorganic Chemistry. 47: 3832–3840. PMID 18380458. doi:10.1021/ic7024439. Consultado em 19 de novembro de 2016. Arquivado do original (pdf) em 25 de abril de 2012
- Verevkin, A.; Pearlman, A.; Slstrokysz, W.; Zhang, J.; Currie, M.; Korneev, A.; Chulkova, G.; Okunev, O.; Kouminov, P.; Smirnov, K.; Voronov, B.; N. Gol'tsman, G.; Sobolewski, Roman (2004). "Ultrafast superconducting single-photon detectors for near-infrared-wavelength quantum communications". Journal of Modern Optics 51 (12): 1447–1458. doi:10.1080/09500340410001670866.
- «Arsenic trioxide». Consultado em 29 de janeiro de 2006