Óxido de bismuto(III)
Óxido de bismuto(III) é um composto inorgânico de fórmula química Bi2O3. É, talvez, o composto de bismuto mais importante para a indústria. É também um composto de partida para a química de bismuto. Encontra-se naturalmente como o mineral bismite (monoclínico) e sphaerobismoite (tetragonal, muito mais raro), mas é geralmente obtido como um subproduto da fundição de minérios de cobre e chumbo. Trióxido de bismuto é frequentemente utilizado para produzir o "ovos de dragão" (efeito dos fogos de artifício), como um substituto de chumbo vermelho.[1]
| Óxido de bismuto(III) Alerta sobre risco à saúde | |
|---|---|
 | |
| Nome IUPAC | Trióxido de bismuto Óxido de bismuto(III) Bismite (mineral) |
| Outros nomes | Bismite, Sesquióxido de bismuto |
| Identificadores | |
| Número CAS | |
| ChemSpider | |
| SMILES |
|
| InChI | 1/2Bi.3O/rBi2O3/c3-1-5-2-4 |
| Propriedades | |
| Fórmula molecular | Bi2O3 |
| Massa molar | 465.96 g/mol |
| Aparência | cristais amarelos ou pó |
| Odor | inodoro |
| Densidade | 8.90 g/cm3, sólido |
| Ponto de fusão |
817 °C, 1090 K, 1503 °F |
| Ponto de ebulição |
1890 °C, 2163 K, 3434 °F |
| Solubilidade em água | insolúvel |
| Solubilidade | solúvel em ácidos |
| Estrutura | |
| Estrutura cristalina | monoclinic, mP20, Space group P21/c (No 14) |
| Geometria de coordenação |
pseudo-octahedral |
| Riscos associados | |
| MSDS | MallBaker MSDS |
| Classificação UE | Não listado |
| NFPA 704 |
 0
1
0
|
| Ponto de fulgor | Não inflamável |
| Compostos relacionados | |
| Outros aniões/ânions | Trissulfeto de bismuto |
| Outros catiões/cátions | Trióxido de arsênio Trióxido de antimônio |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
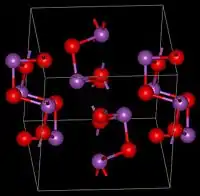
Estrutura
As estruturas adotadas pelo Bi2O3 diferem bastante do óxido de arsênico (III), As2O3, e óxido de antimônio(III), Sb2O3.[2]
Preparação
Trióxido de bismuto é comercialmente feito a partir de nitrato de bismuto. Este último é produzido por dissolução de bismuto em ácido nítrico quente. A adição de hidróxido de sódio em excesso, seguido por aquecimento contínuo da mistura precipita óxido de bismuto (III) como um pó amarelo. Além disso, o trióxido pode ser preparado por ignição de hidróxido de bismuto.[1]
Referências
- Patnaik, Pradyot (2003). Handbook of Inorganic Chemical Compounds. [S.l.]: McGraw-Hill. ISBN 0-07-049439-8. Consultado em 6 de junho de 2009
- Wells A.F. Structural Inorganic Chemistry. 5th. London, England: Oxford University Press, 1984. Print. ISBN 0-19-855370-6