Cianamida de cálcio
Cianamida de cálcio ou cálciocianamida ou ainda, embora erroneamente, cianamida cálcica é um composto químico de cálcio de fórmula CaCN2 usado como fertilizante,[2] primeiramente sintetizado em 1898 por Adolph Frank e Nikodem Caro, responsáveis pela criação do método Frank-Caro.[3] É formado quando carbeto de cálcio reage com nitrogênio.
- CaC2 + N2 → CaCN2 + C
| Cianamida de cálcio Alerta sobre risco à saúde | |
|---|---|
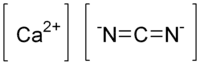 | |
| Nome IUPAC | Calcium cyanamide |
| Outros nomes | Sal de cálcio de cianamida , Cal de nitrogênio, UN 1403, Nitrolima |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| ChemSpider | |
| Número RTECS | GS6000000 |
| SMILES |
|
| InChI | 1/CH2N2.Ca/c2-1-3;/h2H2;/q;+2 |
| Propriedades | |
| Fórmula molecular | CaCN2 |
| Massa molar | 80,102 g/mol |
| Aparência | Sólido branco (Frequentemente cinza ou preto devido a impurezas) |
| Odor | Inodoro |
| Densidade | 2,29 g/cm3 |
| Ponto de fusão |
1340 °C [1] |
| Ponto de ebulição |
1150-1200 °C (sublim.) |
| Solubilidade em água | Reage |
| Riscos associados | |
| MSDS | ICSC 1639 |
| Classificação UE | Nocivo (Xn) Irritante (Xi) |
| Índice UE | 615-017-00-4 |
| NFPA 704 |
 0
3
1
|
| Frases R | R22 R37 R41 |
| Frases S | S2 S22 S26 S36/37/39 |
| Ponto de fulgor | Não inflamável |
| Compostos relacionados | |
| Compostos relacionados | Cianamida Carbeto de cálcio |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
A reação ocorre normalmente em grandes câmaras de aço. Um elemento de carbono eletrificado aquece os reagentes ao rubro. Nitrogênio é pressurizado a 2 atmosferas. Ele cristaliza no sistema cristalino hexagonal com grupo espacial R3m e parâmetros de rede a = 3,67, c = 14,85 (.10−1 nm).[4]
Preparação
Cianamida de cálcio é preparada a partir do carbeto de cálcio. O carbeto em pó é aquecido a aproximadamente 1.000°C em um forno elétrico no qual nitrogênio é passado por várias horas. O produto é esfriado a temperatura ambiente e qualquer carbeto não reagido é removido cuidadosamente com água.
- CaC2 + N2 → CaCN2 + C (ΔHƒ°= –69.0 kcal/mol at 25°C)
Este processo é chamado de processo Frank-Caro.
Referências
- Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
- Auchmoody, L.R.; Wendel, G.W. (1973). «Effect of calcium cyanamide on growth and nutrition of plan fed yellow-poplar seedlings». U.S. Department of Agriculture, Forest Service. Consultado em 18 de julho de 2008
- «History of Degussa: Rich harvest, healthy environment». Consultado em 18 de julho de 2008
- F. Brezina, J. Mollin, R. Pastorek, Z. Sindelar. Chemicke tabulky anorganickych sloucenin (Chemical tables of inorganic compounds). SNTL, 1986.