Citrato de cálcio
O citrato de cálcio é um sal originado do ácido cítrico de fórmula molecular Ca3(C6H5O7)2. Também chamado de "sal azedo", é utilizado na preservação e condimentação dos alimentos e como suavizador de água, por possuir a propriedade de "quebrar" íons metálicos. É também encontrado em alguns suplementos alimentares.
| Citrato de cálcio Alerta sobre risco à saúde | |
|---|---|
 | |
| Nome IUPAC | 2-hydroxy-1,2,3-propane- tricarboxylic acid calcium salt (2:3) |
| Outros nomes | E333 |
| Identificadores | |
| Número CAS | |
| Número EINECS | |
| SMILES |
|
| Propriedades | |
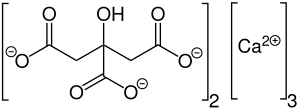
| Fórmula molecular | Ca3(C6H5O7)2 |
| Massa molar | 498.46 g/mol (anidro) |
| Aparência | Pó branco |
| Densidade | 1.63 g/cm3, sólido |
| Ponto de fusão |
120 °C (perde água) |
| Ponto de ebulição |
Decompõe-se |
| Solubilidade em água | 0.095 g/100 ml (25 °C) |
| Riscos associados | |
| MSDS | External MSDS |
| Principais riscos associados |
Irritante |
| Compostos relacionados | |
| Outros catiões/cátions | Citrato de sódio |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Propriedades químicas
Como o ácido cítrico, o citrato de cálcio tem um sabor azedo. Como outros sais, entretanto, ele também tem um sabor salgado. Por esta razão, citratos tais como os de sódio e o de cálcio são comumente chamados "sais azedos".
Produção
Citrato de cálcio é um intermediário na produção do ácido cítrico do processo de fermentação pelo qual o ácido cítrico é obtido industrialmente.[1] O ácido cítrico no caldo é neutralizado por hidróxido de cálcio, precipitando citrato de cálcio insolúvel. É então filtrado e separado do restante do caldo, lavado e então dá o citrato de cálcio limpo.
- 2 H3C6H5O7 + 3 Ca(OH)2 → Ca3(C6H5O7)2 + 6 H2O
O citrato de cálcio assim produzido pode ser vendido diretamente, ou poderá ser convertido em ácido cítrico usando ácido sulfúrico diluído.
Papel biológico
Suplementos de citrato de cálcio podem aumentar a toxicidade do alumínio.[2] Pacientes com doenças renais apresentam aumento do risco de toxicidade.
Biodisponibilidade é 2.5 vezes mais alta que do carbonato de cálcio. Por esta razão, pacientes que passaram pela cirurgia em Y de Roux para perda de peso, gastroplastia restritiva, (também conhecida como derivação gastrointestinal) são usualmente instruídos a tomar citrato de cálcio como suplemento de suas dietas.
Referências
- «Use of Lime in the Chemical Industry». National Lime Association. Consultado em 25 de novembro de 2006. Arquivado do original em 29 de setembro de 2006
- Zdenko Rengel (1992). «Role of calcium in aluminium toxicity». New Phytol. 121: 499-513
Literatura e ligações externas
- Römpp Chemielexikon, 9. Aufl. (Herausgeber: Falbe/Regitz), S. 553
- Kurt Schreier, Hans Wolf: Untersuchungen über den Einfluß der Citronensäure auf den Calciumstoffwechsel. European Journal of Pediatrics, Vol. 67, No. 5 (1950) 526–544
- HJ Heller, LG Greer, SD Haynes, Poindexter JR, and CY Pak: Pharmacokinetic and pharmacodynamic comparison of two calcium supplements in postmenopausal women. Journal of C linical Pharmacology, Vol. 40 (2000) 1237–1244
- Davies KM, Heaney RP, Recker RR, et al: Calcium intake and body weight. Journal of Clinical Endocrinology & Metabolism, Vol. 85, No. 12 (2000) 4635–4638
- Heaney RP, Davies KM, Barger-Lux MJ: Calcium and weight: clinical studies. Journal of the American College of Nutrition, Vol. 21, No. 2 (2002) 152S–155S
- Parikh SJ, Yanovski JA: Calcium intake and adiposity. American Journal of Clinical Nutrition, Vol. 77, No. 2 (2003) 281–287
- Pereira MA, Jacobs DR, Jr., Van Horn L, Slattery ML, Kartashov AI, Ludwig DS: Dairy consumption, obesity, and the insulin resistance syndrome in young adults: the CARDIA Study. Jama, Vol. 287, No. 16 (2002) 2081–2089
- Zemel MB, Shi H, Greer B, Dirienzo D, Zemel PC: Regulation of adiposity by dietary calcium. Faseb Journal, Vol. 14 (2000) 1132–1138