Cloreto de sulfurila
Cloreto de sulfurila é o composto inorgânico de fórmula química SO2Cl2. Em temperatura ambiente, apresenta-se como um líquido incolor com odor pungente. Cloreto de sulfurila não é encontrado na natureza, como pode ser inferido pela sua rápida hidrólise.
| Cloreto de sulfurila Alerta sobre risco à saúde | |
|---|---|
 | |
 | |
| Nome IUPAC | Cloreto de sulfurila |
| Outros nomes | Cloreto de sulfonila Cloreto sulfúrico |
| Identificadores | |
| Número CAS | |
| Número EINECS | |
| Propriedades | |
| Fórmula molecular | SO2Cl2 |
| Massa molar | 134.965 g/mol |
| Aparência | Líquido incolor com odor pungente, cor amarela em repouso. |
| Densidade | 1.667 g/cm3 (20 °C) |
| Ponto de fusão |
-54.1 °C |
| Ponto de ebulição |
69.4 °C |
| Solubilidade em água | hidrolisa, formando cloreto de hidrogênio e ácido sulfúrico |
| Solubilidade | miscível com benzeno, tolueno, clorofórmio, CCl4, ácido acético glacial |
| Índice de refracção (nD) | 1.4437 (20 °C) [1] |
| Riscos associados | |
| Classificação UE | Corrosivo (C) |
| Índice UE | 016-016-00-6 |
| NFPA 704 |
 0
3
2
|
| Frases R | R14, R34, R37 |
| Frases S | S1/2, S26, S45 |
| Ponto de fulgor | Não inflamável |
| Compostos relacionados | |
| haleto de sulfurila relacionados | Fluoreto de sulfurila |
| Compostos relacionados | Cloreto de tionila Ácido clorossulfônico Ácido sulfúrico |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Cloreto de sulfurila é comumente confundido com o cloreto de tionila, SOCl2. As propriedades destes dois oxicloretos de enxofre são claramente diferentes: cloreto de sulfurila é uma fonte de cloro enquanto que o cloreto de tionila é um fonte de íons cloreto. Uma nomenclatura alternativa fornecida pela IUPAC é sulfuroyl dichloride (cloreto de sufuroíla).
Estrutura
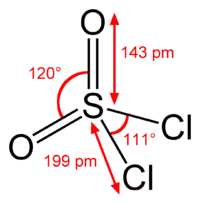
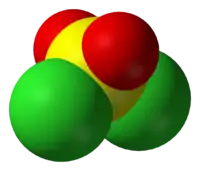
O enxofre é tetraédrico no SO2Cl2, sendo ligado a dois átomos de oxigênio via ligações duplas e a dois átomos de cloro via ligações simples. O estado de oxidação do átomo de enxofre é +6, como no H2SO4.
Reações
Cloreto de sulfurila reage com água liberando cloreto de hidrogênio gasoso e ácido sulfúrico:
- 2 H2O + SO2Cl2 → 2 HCl + H2SO4
Produção
Ele é produzido pela reação do dióxido de enxofre com cloro na presença de um catalisador, tal como o carvão ativado, ou pela decomposição do ácido clorossulfúrico:[2]
O produto bruto pode ser purificado por destilação fracionada. É incomum preparar SO2Cl2 no laboratório porque ele é comercialmente disponível. Cloreto de sulfurila pode também ser considerado um derivado do ácido sulfúrico.[3]
Referências
- Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 383-5.
- C.Michael Hogan. 2011. Sulfur. Encyclopedia of Earth, eds. A.Jorgensen and C.J.Cleveland, National Council for Science and the environment, Washington DC