Difluoreto de oxigénio
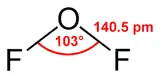
O difluoreto de oxigénio é um composto químico de fórmula OF2. A molécula apresenta uma forma "curva", conforme previsto pela teoria VSEPR. É um gás muito tóxico, um forte oxidante, mas não é de uso comum.
| Oxygen difluoride Alerta sobre risco à saúde | |
|---|---|
 | |
 | |
| Outros nomes | oxygen fluoride hypofluorous anhydride |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| ChemSpider | |
| ChEBI | |
| Número RTECS | RS2100000 |
| SMILES |
|
| InChI | 1/F2O/c1-3-2 |
| Propriedades | |
| Fórmula molecular | OF2 |
| Massa molar | 53.9962 g/mol |
| Aparência | Gás incolor, condenssado é um líquido de cor pálida amarelada. |
| Odor | peculiar, desagradável |
| Densidade | 1.90 g/cm3 (-224° C, líquido), 1.719 g/cm3 (-183° C, líquido), 1.521 g/cm3 (liquid at −145 °C), 1.88 g/l (gás a temperatura ambiente) |
| Ponto de fusão |
−223.8 °C, 49 K, -371 °F |
| Ponto de ebulição |
−144.75 °C, 128 K, -229 °F |
| Solubilidade em água | hydrolyzes[1] |
| Pressão de vapor | >1 atm (20°C)[2] |
| Termoquímica | |
| Entalpia padrão de formação ΔfH |
24.5 kJ mol−1 |
| Entropia molar padrão S |
246.98 J/mol K |
| Capacidade calorífica molar Cp 298 |
43.3 J/mol K |
| Riscos associados | |
| EUA Limite de exposição permissível (PEL) |
TWA 0.05 ppm (0.1 mg/m3)[2] |
| Compostos relacionados | |
| Compostos relacionados | HFO O2F2 NHF2 NF3 SCl2 |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Sintese
O difuoreto de oxigénio foi pela primeira vez descrito por Lebeau e Damiens, em 1929; foi obtido por electrólise de uma mistura fundida de fluoreto de potássio e fluoreto de hidrogénio na presença de uma pequena quantidade de água.[3][4] Actualmente, a síntese ocorre por reação de flúor gasoso com uma solução diluída de hidróxido de sódio; é formado também fluoreto de sódio como produto secundário:
- 2F2 + 2NaOH → OF2 + 2NaF + H2O
Reactividade
O difluoreto de oxigénio é um forte oxidante, tal como é sugerido pelo fato de que neste composto o número de oxidação do átomo de oxigénio é +2, ao invés de -2. O OF2 é o mais estável dos fluoretos de oxigénio. Quando é puro, é estável, mesmo em 200 °C; acima desta temperatura decompõe-se em oxigénio e flúor com um mecanismo radical.
O OF2 reage com muitos metais formando óxidos e fluoretos. Também os não-metais reagem: por exemplo, o fósforo reage com OF2 , formando PF5 e POF3; o enxofre forma SO2 e SF4; o xénon, apesar de ser um gás nobre reage formando XeF4 e oxifluoretos de xénon como XeOF2 e XeOF4.
O difuoreto de oxigénio reage muito lentamente com água, formando ácido fluorídrico:
- OF2(aq) + H2O(aq) → 2HF(aq) + O2(g)
Utilização
Sendo um forte oxidante, o fluorento de oxigénio foi no passado estudado como um possível combustível para foguetes.[5] Actualmente não é utilizado em nenhum processo de síntese industrial.
Referências
- http://www.chemyq.com/En/xz/xz1/2818mqnrv.htm
- NIOSH Pocket Guide to Chemical Hazards. «#0475» (em inglês). National Institute for Occupational Safety and Health (NIOSH)
- Lebeau, P.; Damiens, A. (1929). «Sur un nouveau mode de préparation du fluorure d'oxygène» [A new method of preparation of oxygen fluoride]. Comptes rendus hebdomadaires des séances de l’Académie des sciences (em francês). 188: 1253–1255. Consultado em 21 de fevereiro de 2013
- Lebeau, P.; Damiens, A. (1927). «Sur l'existence d'un composé oxygéné du fluor» [The existence of an oxygen compound of fluorine]. Comptes rendus hebdomadaires des séances de l’Académie des sciences (em francês). 185: 652–654. Consultado em 21 de fevereiro de 2013
- J. F. Judge (1961). Missiles Rockets. 9: 22
Bibliografia
- Greenwood, N. N.; A. Earnshaw (1997). Chemistry of the elements 2 ed. Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4
- A. G. Streng (1963). «The oxygen fluorides». Chem. Rev. 63: 607-624