Fluoreto de zinco
Fluoreto de zinco é um composto de zinco de fórmula ZnF2. Se forma pela reação de óxido ou hidróxido de zinco com ácido fluorídrico ou pela reação do metal com o ácido ou ainda por reações de dupla troca. Fluoreto de zinco é um sólido branco pouco solúvel em água.
| Fluoreto de zinco Alerta sobre risco à saúde | |
|---|---|
 | |
| Identificadores | |
| Número CAS | , 13986-18-0 (tetrahydrate) |
| PubChem | |
| ChemSpider | |
| Número RTECS | ZH3200000 |
| SMILES |
|
| InChI | 1/2FH.Zn/h2*1H;/q;;+2/p-2 |
| Propriedades | |
| Fórmula molecular | ZnF2 |
| Massa molar | 103.406 g/mol (anhydrous) 175.45 g/mol (tetrahydrate) |
| Aparência | Agulhas brancas Higroscopicas |
| Densidade | 4.95 g/cm3 (anhydrous) 2.30 g/cm3 (tetrahydrate) |
| Ponto de fusão |
872 °C (anhydrous) |
| Ponto de ebulição |
1500 °C (anhydrous) |
| Solubilidade em água | .000052 g/100 mL (anhydrous) 1.52 g/100 mL, 20 °C (tetrahydrate) |
| Solubilidade | parcialmente soluvel em HCl, HNO3, ammonia |
| Estrutura | |
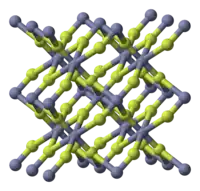
| Estrutura cristalina | tetragonal (anhydrous), tP6 |
| Grupo de espaço | P42/mnm, No. 136 |
| Riscos associados | |
| NFPA 704 |
 0
2
1
|
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Básico
Fluoreto de zinco (ZnF2) é um composto químico inorgânico. Ele é encontrado como a forma anidra e também como o tetrahidrato, ZnF2.4 H2O (estrutura cristalina romboédrica). Ele tem um alto ponto de fusão e tem a estrutura cristalina do rutilo contendo átomos de zinco hexacoordenados, o que sugere caráter iônico apreciável em sua ligação química.[1] Ao contrário dos outros haletos de zinco, ZnCl2, ZnBr2 e ZnI2, não é muito solúvel em água.[1]
Preparação e reações
Fluoreto de zinco pode ser sintetizada de várias formas.
1. Reação de um sal de fluoreto com cloreto de zinco, para produzir fluoreto de zinco e um sal de cloreto, em solução aquosa
2. A reação do zinco metálico com flúor gasoso.
3. Reação do ácido fluorídrico com zinco, para produzir gás hidrogênio (H2) e fluoreto de zinco (ZnF2).
Fluoreto de zinco pode ser hidrolisada por água quente para formar o fluoridróxido de zinco, Zn(OH)F.[2]
Referências
- Verevkin, A.; Pearlman, A.; Slstrokysz, W.; Zhang, J.; Currie, M.; Korneev, A.; Chulkova, G.; Okunev, O.; Kouminov, P.; Smirnov, K.; Voronov, B.; N. Gol'tsman, G.; Sobolewski, Roman (2004). "Ultrafast superconducting single-photon detectors for near-infrared-wavelength quantum communications". Journal of Modern Optics 51 (12): 1447–1458. doi:10.1080/09500340410001670866.
- Studies on metal hydroxy compounds. I. Thermal analyses of zinc derivatives ε-Zn(0H)2, Zn5(OH)8C12.H20, β- ZnOHC1, and ZnOHF, K SRIVASTAVA, EA SECCO - Canadian Journal of Chemistry, 1967 579-583