Iodeto de berílio
O Iodeto de berílio é o composto químico com a fórmula BeI2 . É muito higroscópico e reage violentamente com a água, formando ácido hidroiódico .
| Iodeto de berílio Alerta sobre risco à saúde | |
|---|---|
 | |
| Nome IUPAC | Iodeto de Berílio |
| Nome sistemático | Iodeto de Berílio |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| ChemSpider | |
| SMILES |
|
| InChI | 1/Be.2HI/h;2*1H/q+2;;/p-2 |
| Propriedades | |
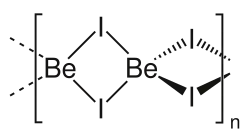
| Fórmula molecular | BeI2 |
| Massa molar | 262.821 g/mol |
| Aparência | Cristais incolores em forma de agulha |
| Densidade | 4.325 g/cm3 |
| Ponto de fusão |
480 °C, 753 K, 896 °F |
| Ponto de ebulição |
590 °C, 863 K, 1094 °F |
| Solubilidade em água | reacts with water[carece de fontes] |
| Solubilidade | Slightly soluble in CS2 Soluble in ethanol, diethyl ether[1] |
| Estrutura | |
| Estrutura cristalina | Ortorrômbica |
| Termoquímica | |
| Entalpia padrão de formação ΔfH |
-192.62 kJ/mol |
| Entalpia padrão de combustão ΔcH |
19 kJ/mol |
| Entropia molar padrão S |
130 J/mol K |
| Capacidade calorífica molar Cp 298 |
71.14 J/(mol × K) |
| Farmacologia | |
| Riscos associados | |
| Principais riscos associados |
Ver Beriliose |
| NFPA 704 |
 3
3
2
|
| EUA Limite de exposição permissível (PEL) |
TWA 0.002 mg/m3 C 0.005 mg/m3 (30 minutos), com um pico máximo de 0.025 mg/m3 (de Be) |
| Compostos relacionados | |
| Outros aniões/ânions | Fluoreto de berílio Cloreto de berílio Brometo de berílio |
| Outros catiões/cátions | Iodeto de magnésio Iodeto de cálcio Iodeto de estrôncio Iodeto de bário |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Reações
O iodeto de berílio pode ser preparado reagindo o metal de berílio com iodo elementar a temperaturas de 500°C a 700°C:
O iodeto de berílio também é formado quando o carboneto de berílio reage com o iodeto de hidrogénio na fase gasosa :
O iodo no iodeto de berílio é facilmente substituído por outros halogénios; reage com o flúor que origina fluoreto de berílio e fluoretos de iodo, com o cloro, originando cloreto de berílio e com o bromo, originando brometo de berílio. O iodeto de berílio também reage violentamente com agentes oxidantes, como o clorato e o permanganato, libertando vapores púrpura de iodo. O sólido e o vapor são ambos inflamáveis no ar.
Aplicações
O iodeto de berílio pode ser usado na preparação de berílio de alta pureza pela decomposição do composto num filamento de tungstênio quente.
Referências
- Parsons, Charles Lathrop (1909), The Chemistry and Literature of Beryllium, Easton, Pa.: Chemical Publishing, pp. 22–23, consultado em 10 de dezembro de 2007