Nitrosobenzeno
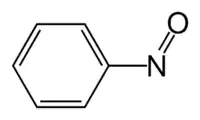
Nitrosobenzeno é o composto orgânico de fórmula C6H5NO, abreviado algumas vezes como PhNO (de phenyl + nitroso). O composto pode ser visto como um híbrido de oxigênio singular O2 e azobenzeno. Estas espécies diamagnéticas existem em equilíbrio com seu dímero.
| Nitrosobenzene Alerta sobre risco à saúde | |
|---|---|
 | |
| Nome IUPAC | Nitrosobenzene |
| Outros nomes | ? |
| Identificadores | |
| Número CAS | |
| Número RTECS | DA6497525 |
| SMILES |
|
| Propriedades | |
| Massa molar | 107.11 g/mol |
| Aparência | sólido incolor |
| Densidade | ? g/cm3, ? |
| Ponto de fusão |
65-69 °C |
| Ponto de ebulição |
59 °C, 18 mm Hg |
| Solubilidade em água | baixa |
| Solubilidade em outros solventes | sol. em solventes orgânicos |
| Estrutura | |
| Forma molecular | N é sp2 |
| Riscos associados | |
| Principais riscos associados |
tóxico |
| Frases R | 20/21-25 |
| Frases S | 26-36/37-45 |
| Compostos relacionados | |
| Compostos relacionados | Nitrobenzeno Anilina |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Preparação
C6H5NO foi primeiramente descrito por Adolf Baeyer em 1874,[1] que o preparou pela reação de difenilmercúrio e brometo de nitrosila, "Bringt man eine Loesung von NOBr in Benzol in eine Loesung von Quecksilberphenyl in Benzol …":
- [C6H5]2Hg + BrNO → C6H5NO + C6H5HgBr
A moderna síntese envolve a redução de nitrobenzeno a fenilhidroxilamina, C6H5NHOH, a qual é então oxidada por Na2Cr2O7.[2] C6H5NO foi também preparado por Caro via a oxidação de anilina usando ácido peroximonosulfúrico (ácido de Caro).[3] É usualmente purificado por destilação por vapor, onde se apresenta como um líquido verde que ao se solidificar torna-se um sólido incolor.
Reações Características
O monômero sofre reações de Diels-Alder com dienos.[4] Mais caracteristicamente nitrosobenzeno condensa-se com grupos metileno e amina "ativos", e.g. de ésteres malônicos. Condensação com anilina resulta em derivados de azobenzene (reação de Mills)[5] e condensação com benzilcianida PhCH2CN a imina PhC(CN)=NPh (reação de Ehrlich-Sachs).[6]
Redução de PhNO produz C6H5NH2.
Ver também
Referências
- Baeyer, A. "Nitrosobenzol und Nitrosonaphtalin" Chemische Berichte 1874, volume 7, pp.1638–1640.
- G. H. Coleman, C. M. McCloskey, F. A. Stuart "Nitrosobenzene" Organic Syntheses, Collected Volume 3, p.668. http://www.orgsyn.org/orgsyn/pdfs/CV3P0668.pdf Arquivado em 30 de setembro de 2007, no Wayback Machine.
- H. Caro, Z. angew. Chem., volume 11, p 845ff (1898).
- H. Yamamoto, N. Momiyama "Rich Chemistry of Nitroso Compounds" Chemical Communications 2005, pp.3514–3525.
- H. D. Anspon (1955). «p-Phenylazobenzoic Acid». Org. Synth.; Coll. Vol., 3
- H. Feuer in S. Patai (ed.) "The Chemistry of the Nitro and Nitroso Groups Part 1," Wiley: New York. pp. 278-283