Oxamida
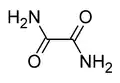
Oxamida é a diamida do ácido oxálico, um composto orgânico. É um sólido branco e cristalino, solúvel em etanol, ligeiramente solúvel em água e insolúvel em éter dietílico. É a diamida derivada do ácido oxálico.
| Oxamide Alerta sobre risco à saúde | |
|---|---|
 |
 |
| Nome IUPAC | Ethanediamide |
| Outros nomes | Oxamide Oxalamide Oxamimidic acid Diaminoglyoxal Oxalic acid diamide 1-Carbamoyl-formimidic acid |
| Identificadores | |
| Número CAS | |
| Propriedades | |
| Fórmula molecular | C2H4N2O2 |
| Massa molar | 88.0654 g/mol |
| Aparência | White powder |
| Densidade | 1.667 g/cm3 |
| Solubilidade em água | Soluble |
| Solubilidade | ethanol |
| Riscos associados | |
| Classificação UE | Mild Irritant (6.1) |
| Frases R | R36 |
| Frases S | S25 |
| Ponto de fulgor | >300 °C |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Produção e aplicações
Oxamidas são produzidos de Cianeto de hidrogênio, oxidado do cianogênio e depois hidrolisado.[1]
A maior aplicação é como substituto da ureia em fertilizantes, sendo muitas vezes preferido por liberar a amônia mais lentamente, o que é preferível em alguns processos agrícolas. Também utilizado como estabilizante em preparações de nitrocelulose.
Reações
Acima de 350°C se decompõe em cianogênio e água [2]
Referências
- Wilhelm Riemenschneider, Minoru Tanifuji "Oxalic Acid" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a18_247 10.1002/14356007.a18_247.
- Nguyen T.L., Fowler F.W., Lauher J.W., "Commensurate and incommensurate hydrogen bonds. An exercise in crystal engineering." Journal of the American Chemical Society, 123(44), pp. 11057-64, 2001. doi:10.1021/ja016635v
Ligações externas
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.