Peróxido de cromo
Em química, o peróxido de cromo(VI) é um composto do elemento de transição cromo, no estado de oxidação +6, que pertence à classe dos óxidos peróxidos. Se apresenta na cor azulada[1] e é extremamente reativo, podendo ser estabilizado em solventes orgânicos, como por exemplo éter.[2] Se isolado na forma de aducto (por exemplo CrO5[OR2]2),[1] forma cristais extremamete explosivos e sensíveis ao atrito.
| Peróxido de cromo Alerta sobre risco à saúde | |
|---|---|
 | |
| Nome IUPAC | peróxido de cromo(VI) |
| Outros nomes | peróxido de cromo, peróxido oxído de cromo, peroxocromo |
| Propriedades | |
| Fórmula molecular | CrO5 |
| Massa molar | 131,99 g/mol |
| Aparência | azulado escuro |
| Solubilidade em água | solúvel (decompõe sem estabilizadores) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
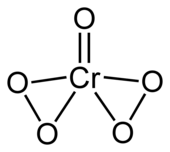
A molécula do composto possui a fórmula elementar CrO5, sendo que um átomo de oxigênio se encontra na forma de óxido (O2-) e quatro átomos de oxigênio no estado de peróxido (dois grupos [O—O]2-). A fórmula molecular pode portanto ser descrita na forma CrO(O2)2.
Obtenção
O peróxido de cromo é obtido em solução através da ação de peróxidos sobre cromatos e dicromatos.
-peroxide_analysis.jpg.webp)
Exemplos
- Por exemplo reação entre hidrogeno cromato, ácido sulfúrico e água oxigenada:[2]
O composto resultante pode ser estabilizado na forma aducto com éter dietílico ou piridina, resultando respectivamente em (C4H10)2O→CrO(O2)2 e CrO(O2)2·N(C5H5).[2][1] Se não estabilizado decompor-se-á rapidamente, formando cromo-(III):
Usos
Em química analítica pode ser usado para se determinar peróxidos qualitativamente, ou até mesmo método de prova da presença de cromatos e dicromatos na solução.[1]
Referências
- Holleman; Wiberg (2007). Lehrbuch der Anorganischen Chemie (em alemão) 102 ed. Nova Iorque/Berlim: Walter de Gruyter. pp. 1570—1571. ISBN 978-3-11-017770-1 .
- E. Riedel; C. Janiak (2002). Anorganische Chemie (em alemão) 5 ed. Nova Iorque/Berlim: Walter de Gruyter. pp. 791—792. ISBN 978-3-11-017439-1 Verifique
|isbn=(ajuda) .