Percloroetileno
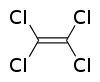
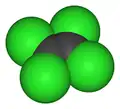
Percloroetileno, nome comercialmente mais usual do tetracloroeteno Cl2C=CCl2 é um composto químico fabricado que é largamente usado para a lavagem a seco de produtos (frequentemente chamado "fluido de limpeza a seco") e desengraxe de metais. É também utilizado na produção de outros produtos químicos e alguns produtos de consumo, especialmente para desengraxe e limpeza.
| Percloroetileno Alerta sobre risco à saúde | |
|---|---|
 |
 |
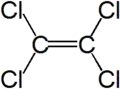 | |
| Nome IUPAC | tetrachloroethene |
| Outros nomes | Tetracloroetileno Tetracloroeteno Percloroeteno perc, PCE |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| Número RTECS | KX3850000 |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | C2Cl4 |
| Massa molar | 165.8 g/mol |
| Aparência | Líquido claro e incolor |
| Densidade | 1,62 g·cm-3 (20 °C)[1] |
| Ponto de fusão |
-22 °C[1] |
| Ponto de ebulição |
121 °C[1] |
| Solubilidade em água | muito pouco solúvel: 160 mg·l?1[1] |
| Solubilidade | miscível com a maioria dos solventes orgânicos [2] |
| Pressão de vapor | 19 hPa (20 °C)[1] |
| Índice de refracção (nD) | 1,5059[2] |
| Viscosidade | 0.89 cP at 25 °C [carece de fontes] |
| Riscos associados | |
| MSDS | External MSDS |
| Principais riscos associados |
Nocivo (Xn), Perigoso para o meio ambiente (N) |
| Frases R | R40 R51/53 |
| Frases S | S2 S23 S36/37 S61 |
| Ponto de fulgor | Não inflamável |
| Compostos relacionados | |
| Halofórmios relacionados relacionados | Hexacloroetano Dicloroacetileno Tetrafluoretileno Tetrabromoetileno Tetraiodoetileno Percloropropeno |
| Compostos relacionados | Tricloroetileno 1,1- e 1,2-Dicloroetileno Cloroetileno (cloreto de vinila) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
A produção mundial deste produto químico de larga aplicação atingiu aproximadamente 1 milhão de toneladas em 1985.[3]
Produção
Michael Faraday sintetizou pela primeira vez o tetracloroeteno em 1821 por decomposição térmica do hexacloroetano em tetracloroeteno e cloro. É utilizado para desengraxar alumínio em empresas que produzem panelas e assadeiras.
- C2Cl6 → C2Cl4 + Cl2
A maior parte do tetracloroeteno é produzido pela cloronólise a alta temperatura de hidrocarbonetos leves. O método é relacionado a descoberta de Faraday já que o hexacloroetano é gerado e termicamente se decompõe.[3] Subprodutos incluem tetracloreto de carbono, cloreto de hidrogênio e hexaclorobutadieno.
Intoxicação
Depende sempre da via:
Ingestão
Ingestão gástrica, náuseas e vómitos. Causa depressão do sistema nervoso central que pode levar à morte. Exposição a doses massivas pode levar a arritemias e morte por potenciação das catecolaminas do miocárdio. Induz necrólise epidérmica tóxica[4]
Referências
- Registo de Tetrachlorethen na Base de Dados de Substâncias GESTIS do IFA
- Felix Geldsetzer, in: Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- M. Rossberg et al. "Chlorinated Hydrocarbons" in Ullmann’s Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. doi:233.pub2 10.1002/14356007.a06 233.pub2
- http://percloroetileno01.wix.com/percloroetileno#!intoxicao/c1hwm
Ligações externas
- «ATSDR Case Studies in Environmental Medicine: Tetrachloroethylene Toxicity» U.S. Department of Health and Human Services
- «Tetrachloroethylene MSDS»
- Australian National Pollutant Inventory (NPI) page
- «Toxic Fumes May Have Made Gunman Snap",» by Julian Kesner, New York Daily News, April 20, 2007.