Silano
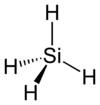
O silano é um composto químico cuja formula é SiH4. É análogo ao metano (CH4 ), porém derivado do silício. Se presume que a temperatura ambiente o silano é um gás pirofórico – entra em combustão espontaneamente em presença do ar sem necessidade de uma fonte de ignição. Entretanto, há quem acredite que o silano é estável e que a formação natural de silanos maiores durante a sua produção é a causa da sua piroforicidade. Acima dos 420 °C o silano se decompõem em silício e hidrogênio, portanto pode ser empregado na deposição química de vapor de silício.
| Silano Alerta sobre risco à saúde | |
|---|---|
 |
 |
| Nome IUPAC | Silano |
| Outros nomes | tetrahidreto de silício hidreto de silício Monosilano Silicano |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número RTECS | VV1400000 |
| Propriedades | |
| Fórmula química | H4Si |
| Massa molar | 32.12 g mol-1 |
| Aparência | Gás incolor |
| Densidade | 1,35 g·l-1 (1 bar, 15 °C, gás) [1] |
| Ponto de fusão |
-185 °C [1] |
| Ponto de ebulição |
-112 °C [1] |
| Solubilidade em água | Insolúvel, sofre hidrólise lenta na água [1] |
| Estrutura | |
| Forma molecular | tetrahedral |
| Momento dipolar | 0 D |
| Termoquímica | |
| Entalpia padrão de formação ΔfH |
34.31kJ/mol |
| Entropia molar padrão S |
283 J mol−1 K−1 |
| Riscos associados | |
| MSDS | ICSC 0564 |
| Índice UE | Não listado |
| Principais riscos associados |
Extremamente inflamável, potencialmente pirofórico |
| NFPA 704 |
 4
2
3
|
| Frases R | R12, R17 |
| Frases S | S9, S16, S33 |
| Ponto de fulgor | gás inflamável |
| Temperatura de auto-ignição |
294 K (21 °C) (~70°F) |
| Limites de explosividade | 1.37–100% |
| EUA Limite de exposição permissível (PEL) |
5 ppm (ACGIH TLV) |
| Compostos relacionados | |
| Compostos de fórmula XH4, em que X é do grupo 14 (antigo 4A), relacionados | Metano Germano Estanano Plumbano |
| Compostos relacionados | Dissilano Metilsilano Clorossilano |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
De forma mais geral, um silano é qualquer análogo dos alcanos, porém derivados do silício. Os silanos consistem numa cadeia de átomos de silício unidos covalentemente a átomos de hidrogênio. A formula geral de um silano é SinH2n+2. Os silanos tendem a ser menos estáveis que seus análogos de carbono, pois a ligação Si-Si é de menor energia que a ligação C-C. O oxigênio decompõem os silanos porque a ligação Si-O é muito estável.
|
Termoquímica | |
|---|---|
| ΔfH0sólido | -1615 kJ/mol |
|
Riscos | |
| Ingestão | Relativamente pouco tóxico porém evitar exposição. |
| Inalação | Relativamente de baixa toxicidade, pode provocar tosse |
| Pele | Irritante |
| Olhos | Irritante |
| Mais informações | Hazardous Chemical Database (Em inglês) |
Nomenclatura
Existe uma nomenclatura regular para os silanos. Cada nome dos silanos consiste na palavra silano precedida por um prefíxo numérico ( di, tri, tetra, etc. ) correspondente ao número de átomos de silício na molécula. Assim Si2H6 se nomeia como disilano, Si3H8 como trisilano, etc. Não existe prefixo para um, SiH4 é simplesmente silano. Os silanos também podem ser nomeados como qualquer outro composto inorgânico, assim o silano é chamado tetrahidreto de silício. Porém, para os silanos de maior cadeia esta nomenclatura torna-se muito complicada. .
Um "ciclosilano" é um silano na forma de anel, assím como um cicloalcano é um alcano cíclico, na forma de anel.
Também existem os silanos ramificados. O radical SiH3- é chamado silil, Si2H5- é disilanil, etc. Se há um trisilano com um grupo silil unido a um átomo de silicio do meio, se obtém um silil trisilano, de forma paralela aos alcanos ramificados.
Os silanos podem apresentar os mesmos grupos funcionais ligados a cadeias saturadas de silicio, como ocorre com os alcanos. Por exemplo, com o grupo OH formará um silanol. Em teoria existe um análogo de silício para cada alcano.
Produção
Industrialmente, o silano é produzido do silício metalúrgico num processo de duas etapas. Na primeira etapa, reage-se o silício com ácido clorídrico numa temperatura aproximada de 300 °C para produzir triclorosilano, junto com gás hidrogênio, de acordo com a equação química:
- Si + 3 HCl → HSiCl3 + H2
O triclorosilano é fervido sobre uma camada resinosa contendo um catalisador que promove sua dismutação em silano e tetracloreto de silício, de acordo com a equação química:
- 4 HSiCl3 → SiH4 + 3 SiCl4
Geralmente os catalisadores mais comuns usados neste processo são os haleto de metal, particularmente o cloreto de alumínio.
Aplicações
Diversas aplicações industriais e médicas existem para os silanos. Os silanos são usados como agentes de acoplamento para aderir porcelana a um compósito, em obturações dentárias, para otimizar a adesão de fibras de vidro ou fibras naturais a matrizes poliméricas usadas na construção civil, moveleira e de transportes. Também são usados para acoplar uma camada bio-inerte sobre implantes de titânio. Outras aplicações incluem: impermeabilizante de água, com hidróxido de alumínio como retardador de chamas, como material de revestimento antigrafítico (proteger contra pichações) de concreto, pedra e cerâmica, e selantes. A “Degussa AG” é a maior produtora comercial de silanos.
Referências
- Registo de Monosilan na Base de Dados de Substâncias GESTIS do IFA, accessado em 15 de Janeiro de 2008
Ligações externas
- «Instituto Nacional de Seguridad e Higiene en el Trabajo de España». : Ficha internacional de segurança química do silano.
- «organofunctional silanes from Degussa AG»
- «organofunctional silanes for building protection - water repellents - masonry protection - Graffiti Controll - sealer - easy to clean surface from Degussa AG»
- http://www.siridion.com chlorosilanes for telecommunication and electronic materials from Degussa