Sulfeto de potássio
Sulfeto de potássio é o composto inorgânico de fórmula química K2S. Este sólido incolor quando puro é raramente encontrado, porque reage rapidamente com água, produzindo bissulfeto (KSH) e hidróxido de potássio (KOH).
| Sulfeto de potássio Alerta sobre risco à saúde | |
|---|---|
 | |
| Nome IUPAC | Potassium sulfide |
| Outros nomes | Dipotassium monosulfide, Dipotassium sulfide, Potassium monosulfide |
| Identificadores | |
| Número CAS | |
| Número RTECS | TT6000000 |
| Propriedades | |
| Fórmula molecular | K2S |
| Massa molar | 110.262 g/mol |
| Aparência | puro: incolor impuro: amarelo-castanho |
| Densidade | 1.8 g/cm3 |
| Ponto de fusão |
840 °C |
| Ponto de ebulição |
decompõe-se |
| Solubilidade em água | converte-se a KSH, KOH |
| Solubilidade em outros solventes | solúvel em etanol e glicerol |
| Estrutura | |
| Estrutura cristalina | antifluorita |
| Riscos associados | |
| Principais riscos associados |
tóxico |
| Frases R | 31-34 |
| Frases S | 26-45 |
| Compostos relacionados | |
| Compostos relacionados | Na2S Li2S |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
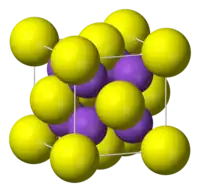
Estrutura
O K2S adota a "estrutura antifluorita", o que significa que os pequenos íons K+ ocupam os sítios tetraédricos fluoreto (F−) na fluorita CaF2, e o íon maior de sulfeto (S2−) ocupa os sítios para Ca2+, octa-coordenados. O Li2S, o Na2S, e o Rb2S cristalizam-se similarmene.[1]
Síntese e reações
Pode ser produzido por aquecimento de K2SO4 com carbono (coque):
- K2SO4 + 4 C → K2S + 4 CO
Em laboratório, uma variedade de métodos existem.[2] K2S forma-se da reação entre enxofre e potássio. No laboratório, esta síntese é usualmente conduzida pela combinação de uma solução de potássio em amônia anidra com o enxofre elementar.
Outro método de obter-se K2S em laboratório envolve a reação de permanganato de potássio e enxofre elementar:
- 2 KMnO4 + S → K2S + 2 MnO2 + 2 O2
Sulfeto é altamente básico, consequentemente K2S hidrolisa completa e irreversivelmente em água de acordo com a seguinte equação:
- K2S + H2O → KOH + KSH
Para muitos propósitos, esta reação é inconsequente dado que a mistura de SH− e OH− comporta-se como uma fonte de S2−. Outros sulfetos de metais alcalinos comportam-se similarmente.[1]
Referências
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 200.