Tetracloreto de selênio
Tetracloreto de selênio é o composto inorgânico com a fórmula SeCl4. Este composto existe como sólido branco amarelado volátil. É um de dois cloretos de selênio normalmente disponíveis, sendo o outro exemplo o monocloreto de selénio , Se2Cl2. SeCl4 é utilizado na síntese de outros compostos de selénio.
| Selenium tetrachloride Alerta sobre risco à saúde | |
|---|---|
 | |
 | |
| Nome IUPAC | Selenium tetrachloride |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| Número RTECS | VS7875000 |
| SMILES |
|
| InChI | 1/Cl4Se/c1-5(2,3)4 |
| Propriedades | |
| Fórmula molecular | SeCl4 |
| Massa molar | 220.771 g/mol |
| Aparência | white to yellow crystals |
| Densidade | 2.6 g/cm³, solid |
| Ponto de fusão |
sublimes at 191.4°C[1] |
| Solubilidade em água | decomposes in water |
| Estrutura | |
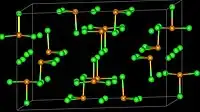
| Estrutura cristalina | Monoclinic, mS80 |
| Grupo de espaço | C12/c1, No. 15 |
| Forma molecular | Seesaw (gas phase)[carece de fontes] |
| Riscos associados | |
| Classificação UE | Toxic (T), Dangerous for the environment (N) |
| NFPA 704 |
 0
3
0
|
| Frases R | R23/25, R33, R35 |
| Frases S | S20/21, S28, S45, S60, S61[2] |
| Ponto de fulgor | non-flammable |
| Compostos relacionados | |
| Outros aniões/ânions | Tetrafluoreto de selênio Tetrabrometo de selênio |
| Outros catiões/cátions | Tetracloreto de enxofre Tetracloreto de telúrio |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Síntese e estrutura
SeCl4 é preparado por tratamento de selênio com cloro : [3] Quando a mistura reacional é aquecida, o produto sublimaa partir do balão de reação. A volatilidade do SeCl4 pode ser explorada para a purificação de selênio.
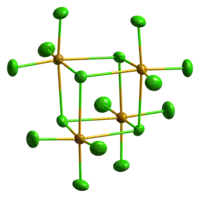
SeCl4 sólido é iônico, formado por cátions SeCl3+ e ânions Cl-. Os cátions são piramidais consistente com as previsões da teoria VSEPR. SeCl4 gasoso contém SeCl2 e cloro, que se recombinam após a condensação.
Reações
O tetracloreto de selênio pode ser reduzido in situ para o dicloreto usando trifenilestibina:
SeCl4 reage com água para dar os ácidos clorídrico e selenoso: [4]
Após o tratamento com dióxido de selênio, dá oxicloreto de selênio: [4]
Referências
- Lide, David R. (1998). Handbook of Chemistry and Physics 87 ed. Boca Raton, FL: CRC Press. 487 páginas. ISBN 0-8493-0594-2. Consultado em 2 de julho de 2008
- «323527 Selenium tetrachloride». Sigma-Aldrich. Consultado em 2 de julho de 2008
Nota
- Este artigo foi inicialmente traduzido, total ou parcialmente, do artigo da Wikipédia em inglês cujo título é «Selenium tetrachloride», especificamente desta versão.