Ácido glicólico
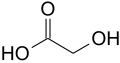
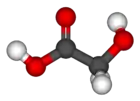
Ácido glicólico[9] (ou ácido hidroxiacético[10]) é o menor α-hidroxiácido (AHA). É um sólido cristalino incolor, inodoro e higroscópico, sendo altamente solúvel em água. É utilizado em muitos produtos para cuidados com a pele. O ácido glicólico é encontrado nalgumas plantas açucareiras.
| Ácido glicólico Alerta sobre risco à saúde | |
|---|---|
 |
 |
| Nome IUPAC | 2-Hydroxyethanoic acid |
| Outros nomes | ácido glicólico, ácido hidroxiacético |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| Número RTECS | MC5250000 |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | C2H4O3 |
| Massa molar | 76.05 g/mol |
| Aparência | branco, sólido quebradiço |
| Densidade | 1,26 g·cm-3[1] |
| Ponto de fusão |
80 °C [1] |
| Ponto de ebulição |
100 °C (decompõe-se)[1] |
| Solubilidade em água | muito solúvel (1000 g·l-1 a 25 °C)[2] |
| Solubilidade em outros solventes | muito solúvel em acetona, etanol e éter dietílico[3][4] |
| Pressão de vapor | 27,5 hPa (25 °C)[1] |
| Acidez (pKa) | 3,83 [2] |
| Riscos associados | |
| Principais riscos associados |
Corrosivo (C) |
| NFPA 704 |
 1
3
0
|
| Frases R | R34 |
| Frases S | S22 S26 S36/37/39 S45 |
| Ponto de fulgor | 129 °C[5] |
| LD50 | 1000 mg·kg-1 (gato, intravenoso) [6] 7,1 mg·m–3/4h (rato, inalação, LC50) [7] 1920 mg·kg-1 (porquinho-da-Índia, oral) [8] 1950 mg·kg-1 (rato, oral) [8] |
| Compostos relacionados | |
| Outros aniões/ânions | Glicina (ácido aminoetanoico) Ácido fluoroacético Ácido tioglicólico Ácido metoxiacético |
| Ácidos carboxílicos relacionados | Ácido acético Ácido glioxílico (ácido oxoetanoico) Ácido oxálico (etanodicarboxilico) Ácido lático (C3) |
| Compostos relacionados | Glicolaldeído (hidroxi-etanal) Etilenoglicol (etano-1,2-diol) Glicolato de metila |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Produção
O ácido glicólico é produzido pela reação do ácido cloroacético com o hidróxido de sódio, seguida de uma re-acidificação. A reação pode ser equacionada da seguinte maneira:
- ClCH2CO2H + NaOH → HOCH2CO2H + NaCl
Desta forma, algumas milhares de toneladas de ácido glicólico são produzidas anualmente. Outros métodos, usados em menor escala, incluem a hidrogenação do ácido oxálico e a hidrólise das cianohidrinas derivadas do formaldeído.[11]
O ácido glicólico pode também ser produzido através de um processo enzimático bioquímico, que produz menos impurezas se comparado à síntese química tradicional, requer menos energia na produção e gera uma quantidade menor de subprodutos. Este processo é utilizado pela companhia CrossChem.[12]
Usos
O ácido glicólico é um útil intermediador de sínteses orgânicas, numa gama de reações que incluem: oxidação-redução, esterificação e polimerização de longas cadeias (polimerização). É utilizado como um monómero, na preparação do ácido poliglicólico e outros copolímeros biocompatíveis (ex. PLGA). Entre outros usos, este composto é empregado na indústria têxtil como agente pigmentador e curtidor; em processamento de alimentos, como agente flavorizante e como conservante. O ácido glicólico é geralmente incluído em emulsões de polímeros, solventes e aditivos para tintas e pinturas como forma de melhorar as propriedades de fluxo e para transmitir brilho.[11]
Devido ao seu excelente poder de absorção pela pele, o ácido glicólico tem várias aplicações em produtos de cuidados dermatológicos. É normalmente utilizado em peelings químicos por dermatólogos, em concentrações que variam entre os 30% e os 80%, ou em kits domésticos, com concentrações inferiores a 12%. Além da concentração, o pH é importante na determinação da eficácia da solução. O pH de uma solução de ácido glicólico, num peeling médico, pode ser de até 0,6, o que é forte o suficiente para lesionar a epiderme, enquanto que os peelings caseiros têm pH mais alto, próximo a 2,5.[13] O ácido glicólico mostra-se benéfico para peles com propensão à acne, pois ajuda a manter os poros livres do excesso de queratinócitos e também para diminuir sinais e manchas da idade, bem como a queratose actínica.[14]
Da perspectiva comercial, derivados importantes incluem os ésteres metílicos (CAS# 96-35-5) e etílicos (CAS# 623-50-7) que, ao contrário do ácido precursor, são facilmente destiláveis (p.e. 147-9 e 158-159 °C, respectivamente). O éster butílico (p.e. 178-186 °C) é componente de alguns vernizes, sendo desejado por ser não-volátil e ter boas propriedades de dissolução.[11]
Segurança
O ácido glicólico é altamente irritante.[15] Como o etileno glicol, é metabolizado a ácido oxálico, sendo perigoso se ingerido.
Referências
- Registo de CAS RN 79-14-1 na Base de Dados de Substâncias GESTIS do IFA.
- (en) « Ácido glicólico » em ChemIDplus
- Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- «DuPont Glycolic Acid Technical Information». Consultado em 6 de julho de 2006. Arquivado do original em 14 de julho de 2006
- «Glycolic Acid MSDS». University of Akron. Consultado em 18 de setembro de 2006[ligação inativa]
- Prehled Prumyslove Toxikologie; Organicke Latky. Marhold, J., Prague, Czechoslovakia, Avicenum, 1986, Pg. 656, 1986.
- Inhalation Toxicology. Vol. 9, Pg. 435, 1997.
- Journal of Industrial Hygiene and Toxicology. Vol. 23, Pg. 259, 1941.
- Infopédia. «glicólico | Dicionário Infopédia da Língua Portuguesa». Infopédia - Porto Editora. Consultado em 2 de junho de 2022
- Infopédia. «hidroxiacético | Dicionário Infopédia da Língua Portuguesa». Infopédia - Porto Editora. Consultado em 2 de junho de 2022
- Karlheinz Miltenberger "Hydroxycarboxylic Acids, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.
- «GlyAcid EBP Crystalline at CrossChem.net». Arquivado do original em 15 de maio de 2009
- Glycolic Acid Essential Actives, KAVI.
- NATALIA MICHALUN; M. VARINIA MICHALUN; MAURO SILVA. Dicionario de Ingredientes Para Cosmetica E. Senac; ISBN 978-85-221-0891-6. p. 184.
- «Glycolic Acid MSDS». ICSC:NENG1537 International Chemical Safety Cards (WHO/IPCS/ILO) | CDC/NIOSH. Consultado em 8 de junho de 2006. Arquivado do original em 21 de setembro de 2005