Anidrido ftálico
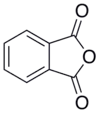
Anidrido ftálico é o anidrido do ácido ftálico de fórmula química C8H4O3.Ele dissolve-se em álcool e alguns outros solventes orgânicos. Sofre hidrólise por água quente, resultando em ácido orto-ftálico.
| Phthalic anhydride Alerta sobre risco à saúde | |
|---|---|
 | |
 | |
| Nome IUPAC | 2-benzofuran-1,3-dione |
| Outros nomes | Isobenzofuran-1,3-dione |
| Identificadores | |
| Número CAS | |
| Número RTECS | TI3150000 |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | C8H4O3 |
| Massa molar | 148.1 g/mol |
| Aparência | white Flakes |
| Densidade | 1.53 g/cm3, solid |
| Ponto de fusão |
131 °C |
| Ponto de ebulição |
295 °C subl. |
| Solubilidade em água | 0.62 g/100g reacts slowly |
| Riscos associados | |
| NFPA 704 |
 1
3
0
|
| Frases R | R22, R37/38, R41, R42/43 |
| Frases S | S2, S23, S24/25, S26, |
| Ponto de fulgor | 152 °C |
| Compostos relacionados | |
| Compostos relacionados | Phthalic acid Phthalimide |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Produção
O Anidrido ftálico é obtido tanto por oxidação catalítica do orto-xileno com O2 (oxigênio):
- C6H4(CH3)2 + 3 O2 → C6H4(CO)2O + 3 H2O
Obs.:Quando se separa o anidrico ftálico de subprodutos tais como o-xileno em água, ou o anidrido maléico, uma série de condensadores é requerida.
Como também pode obtido por oxidação catalítica do naftaleno (chamado processo anidrido ftálico Gibbs, de 1918):
- C10H8 + 4.5 O2 → C6H4(CO)2O + 2 H2O + 2CO2
Os subprodutos da reação do naftaleno são o dióxido de carbono e água.
Aplicações
Anidrido ftálico é largamente usado na indústria na produção de corantes (fluoresceína e derivados, rodamina e derivados, inseticidas, plastificantes, em farmácia, em química analítica, etc. Uma bem conhecida aplicação de sua reatividade é a preparação de corantes derivados da antraquinona, entre eles a quinizarina por reação com para-clorofenol seguido por hidrólise do cloreto.[1]
Preparação de ésteres ftalatos
A reação de alcoólise é a base da produção de ésteres ftalatos, os quais são largamente utilizados como plastificantes.[2] Nos anos 1980, aproximadamente 6.5×109 kg destes ésteres foram produzidos anualmente e a escala de produção cresceu a cada ano, todos derivados do anidrido ftálico. O processo inicia com a reação de anidrido ftálico com álcoois dando os ésteres mistos:
- C6H4(CO)2O + ROH → C6H4(CO2H)CO2R
A segunda esterificação é mais difícil e requer remoção da água formada:
- C6H4(CO2H)CO2R + ROH C6H4(CO2R)2 + H2O
O mais importante diéster é o bis(2-etilhexil) ftalato ("DEHP"), usado na manufatura de cloreto de polivinila.
Síntese orgânica
Anidrido ftalico é um precursor para uma variedade de reagentes úteis em síntese orgânica. Importantes derivados incluem ftalimida e seus muitos derivados. Álcoois quirais formam meio ésteres (ver acima), e estes derivados são frequentemente resolvíveis porque eles formam sais diastereoméricos com aminas quirais tais como brucina.[3] Uma reação relacionada de anel aberto envolve peróxidos para dar o útil peróxido ácido:[4][5]
- C6H4(CO)2O + H2O2 → C6H4(CO3H)CO2H
Referências
- L. A. Bigelow and H. H. Reynolds (1941). «Quinizarin». Org. Synth.; Coll. Vol., 1
- Peter M. Lorz, Friedrich K. Towae, Walter Enke, Rudolf Jäckh, Naresh Bhargava, Wolfgang Hillesheim "Phthalic Acid and Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinheim, 2002.
- Joseph Kenyon (1941). «d- and l-Octanol-2». Org. Synth.; Coll. Vol., 1
- George B. Payne (1973). «Monoperphthalic acid». Org. Synth.; Coll. Vol., 5
- Anidrido ftálico-Guidechem.com