Carbonato de zinco
Carbonato de zinco, algumas vezes tratado como sal de zinco do ácido carbônico, é o composto químico inorgânico de fórmula ZnCO3. É encontrado na natureza no mineral smithsonite. Apresenta-se quando puro como um sólido branco, embora às vezes, comercialmente, apresente-se como amarelado, em purezas de até 98%, inodoro e descrito como sem sabor, normalmente comercializado na forma de pó amorfo fino.
| Carbonato de zinco Alerta sobre risco à saúde | |
|---|---|
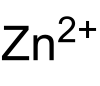 |
 |
| Nome IUPAC | Carbonato de zinco |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Propriedades | |
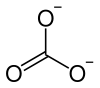
| Fórmula química | CO3Zn |
| Massa molar | 125.4 g mol-1 |
| Densidade | 4,43 g·cm-3[1] |
| Ponto de fusão |
~300 °C (decomp.)[2] |
| Solubilidade em água | 10 mg/l a 20 °C[2] |
| Riscos associados | |
| Frases R | R35 |
| Frases S | S60, S61 |
| Compostos relacionados | |
| Compostos relacionados | Carbonato básico de zinco |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Possui massa específica de 4,4 gramas por cm³. Apresenta solubilidade em água considerada insignificante, mas reage com os ácidos minerais produzindo os respectivos sais de zinco.[3] Decompoem-se em ZnO (óxido de zinco) e CO2 (gás carbônico) à temperatura de 297оС.
Comercialmente apresenta, quando em pó fino, área de superfície específica de aproximadamente 45m2/g e densidade aparente de 0,35g/ml.
Aplicações
É utilizado como um adstringente em cosméticos, como protetor da pele em emulsões, em medicina em pomadas e loções.
É utilizado amplamente em pintura, como agente de activação da transparência em elastômeros, como agente reforçador da coloração na indústria da borracha leitosa e látex, na produção de seda artificial e telhas cerâmicas.
Possui aplicação na indústria do petróleo nas lamas lubrificantes em perfuração de poços e na chamada perfuração oleada, no refino e tratamento como absorvente do enxofre.
É empregado na suplementação animal, incluindo humana, em aditivos e suplementos alimentares, como fonte do microelemento zinco.
O carbonato de zinco também é usado no material de laser da eletrônica, nos fósforos, nos catalisadores, na manufatura de materiais magnéticos.
Corrosão
Na corrosão do zinco, produz-se óxido de zinco quando em atmosfera relativamente seca através da reação entre o zinco e o oxigênio atmosférico. Quando em atmosfera úmida, este óxido é convertido em hidróxido de zinco. O hidróxido e o óxido de zinco reagem por sua vez com o dióxido de carbono presente na atmosfera formando carbonato de zinco, que sendo aderente à superfície e relativamente bastante insolúvel é considerado o principal responsável pela proteção anticorrosiva dos revestimentos galvanizados de zinco.[4] Este filme de carbonato de zinco forma-se rapidamente e sua taxa de crescimento decai com o tempo. Com a restrição do contato dos óxidos e hidróxidos de zinco com o dioxido de carbono atmosférico, o filme protetivo não se forma.[5][6][7][8][9][10]
Segurança
Trata-se de uma substância irritante para os olhos.[3]
Referências
- H. Effenberger, K. Mereiter, J. Zemann, Z. Kristallogr. 1981, 156, 233–243
- Registo de CAS RN 3486-35-9 na Base de Dados de Substâncias GESTIS do IFA, accessado em 31 de Maio de 2009
- Zinc Carbonate - Safety data for zinc carbonate - The Physical and Theoretical Chemistry Laboratory Oxford University (em inglês)
- AMERICAN GALVANIZERS ASSOCIATION; Zinc Coatings – Microstrutures of various zinc coatings. - www.galvanizeit.org - Acessado em 2005.
- HALL, W. L. The corrosion process for and the protective action of galvanized coating. In: 9th International Conference on Hot Dip Galvanizing, Düsseldorf, 1970. p. 3 – 8.
- Graziela de Lima; INFLUÊNCIA DA ADIÇÃO DE DIFERENTES CONCENTRAÇÕES DE BISMUTO, NÍQUEL, ESTANHO E ALUMÍNIO SOBRE A ESPESSURA DE CAMADA, RESISTÊNCIA À CORROSÃO E BRILHO NOS REVESTIMENTOS GALVANIZADOS; DISSERTAÇÃO DE MESTRADO; UNIVERSIDADE DO ESTADO DE SANTA CATARINA – UDESC - CENTRO DE CIÊNCIAS TECNOLÓGICAS – CCT - DEPARTAMENTO DE ENGENHARIA MECÂNICA –DEM - PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS - PGCEM; Joinville; 2007 - www.tede.udesc.br
- Lehto, R. S. (1968). "Zinc". in Clifford A. Hampel. The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. pp. 822–830. LCCN 68-29938.
- Zaki Ahmad; Principles Of Corrosion Engineering And Corrosion Control; Butterworth-heinemann; 2006
- D. A. Jones, Principles and Prevention of Corrosion (2nd ed.), Prentice Hall, Upper Saddle River, 1995.
- D. Pletcher, F.C. Walsh, Industrial Electrochemistry (2nd ed.), Chapman and Hall, London, 1990.