Cloreto de prata
Cloreto de prata é a substância química cuja fórmula é AgCl. Esse sólido cristalino branco, é também conhecido por sua baixa solubilidade em água (comportamento também observado nos cloretos de Tl+ e Pb2+). Sob eluminação ou aquecimento, o cloreto de prata transforma-se em prata + cloro. AgCl aparece na natureza na forma do minério cerargirita.
| Cloreto de prata Alerta sobre risco à saúde | |
|---|---|
 | |
 | |
| Nome IUPAC | Cloreto de prata (I) |
| Outros nomes | cerargyrite, chlorargyrite, horn silver |
| Identificadores | |
| Número CAS | |
| Número RTECS | VW3563000 |
| Propriedades | |
| Fórmula química | AgCl |
| Massa molar | 143.32 g mol-1 |
| Aparência | Sólido branco |
| Densidade | 5.56 g.cm³ |
| Ponto de fusão |
457 °C |
| Ponto de ebulição |
1547 °C |
| Solubilidade em água | 520 μg/100 g at 50 °C |
| Solubilidade | Insolúvel em álcool, diluível em ácidos. Solúvel com amônia, em ácido sulfúrico, em alcális de cianeto, (NH4)2CO3 , brometo de potássio e triosulfato de sódio. |
| Índice de refracção (nD) | 2.071 |
| Estrutura | |
| Estrutura cristalina | halita |
| Termoquímica | |
| Entalpia padrão de formação ΔfH |
−127.01 kJ mol−1 |
| Entropia molar padrão S |
96.25 J mol−1 K−1 |
| Farmacologia | |
| Riscos associados | |
| MSDS | Fischer Scientific |
| NFPA 704 |
 0
2
0
|
| Compostos relacionados | |
| Outros aniões/ânions | Fluoreto de prata(I), Brometo de prata, Iodeto de prata |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Este composto era chamado luna cornata pelos alquimistas medievais.[1]
Coordenação químical
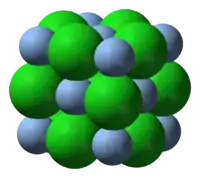
Estruturalmente o sólido adota a mesma configuração do NaCl (Cubo de Face Centrada), com seus íons Ag+ circundados por um octaedro de seis Cl-. AgF e AgBr cristalizam da mesma maneira.[2] AgCl dissolve-se em soluções contendo íons como: Cloreto, Cianeto, Trifenilfosfina, Tiossulfato, Tiocianato e amônia. Cloreto de prata reage com tais íons de acordo com as seguintes equações:
- AgCl(s) + Cl−(aq) → AgCl2−(aq)
- AgCl(s) + 2S2O32−(aq) → Ag[(S2O3)2]3−(aq) + Cl−(aq)
- AgCl(s) + 2NH3(aq) → Ag[(NH3)2]+(aq) + Cl−(aq)
Muitos compostos derivados do AgCl possuem dois, três ou em casos mais raros quatro ligantes, possuindo assim geometria linear, trigonal plana e tetraédrica respectivamente.
Aplicações
- Cloreto de prata é utilizado na confecção de papel fotográfico, visto que reage com fótons para formar imagens
- O eletrodo de cloreto de prata é muito utilizado na eletroquímica
- Cloreto de prata tem sido usado como antídoto para envenenamento por mercúrio, ajudando em sua eliminação.
- Ele é utilizado na fabricação de vidros coloridos nas cores: amarela, âmbar e marrom.
- AgCl possui também ação antimicrobiana por isso é utilizado em materiais cirurgicos (cateteres) e materiais para tratamento de feridas.
- Utilizado, também, em Lentes Fotossensíveis.
Notas
- Histórias da Luz e das Cores, volume 2, Luís Miguel Bernardo
- Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6 (em inglês).