Nitrato de prata
Nitrato de prata é um composto químico de fórmula molecular AgNO3. Comercialmente, costuma chamar-se também de "cáustico lunar",[6] ainda que para uso como reagente analítico em grau de pureza de 99,8% ponderal. Em medicina já foi usado como cauterizador para eliminação de ligeiras tumorações epidérmicas (verrugas e outros), e costumava chamar-se, por isso, de "pedra infernal".[7] Apresenta amplo emprego na ciência analítica e na técnica (é nitrato inorgânico primordial[8]), na indústria e na medicina..
| Nitrato de prata Alerta sobre risco à saúde | |
|---|---|
 | |
 | |
| Nome IUPAC | Nitrato de prata(I), Nitrato de prata |
| Outros nomes | Ácido nítrico prata(1+) sal |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| ChEBI | |
| Número RTECS | VW4725000 |
| SMILES |
|
| InChI | 1/Ag.NO3/c;2-1(3)4/q+1;-1 |
| Propriedades | |
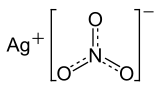
| Fórmula química | AgNO3 |
| Massa molar | 169.86 g mol-1 |
| Aparência | sólido branco |
| Odor | sem odor |
| Densidade | 4.35 g/cm3 (24 °C) 3.97 g/cm3 (210 °C)[1] |
| Ponto de fusão |
209.7 °C, 483 K, 409 °F |
| Ponto de ebulição |
444 °C, 717 K, 831 °F |
| Solubilidade em água | 122 g/100 mL (0 °C) 170 g/100 mL (10 °C) 256 g/100 mL (25 °C) 373 g/100 mL (40 °C) 912 g/100 mL (100 °C)[2] |
| Solubilidade | solúvel em acetona,[1] amônia, éter, glicerol |
| Solubilidade em ácido acético | 0.776 g/kg (30 °C) 1.244 g/kg (40 °C) 5.503 g/kg (93 °C)[3] |
| Solubilidade em acetona | 0.35 g/100 g (14 °C) 0.44 g/100 g (18 °C)[2] |
| Solubilidade em benzeno | 0.22 g/kg (35 °C) 0.44 g/kg (40.5 °C)[2] |
| Solubilidade em etanol | 3.1 g/100 g (19 °C)[2] |
| Solubilidade em acetato de etila | 2.7 g/100 g (20 °C)[3] |
| log P | 0.19[4] |
| Susceptibilidade magnética | −4.57·10−5 cm3/mol[1] |
| Índice de refracção (nD) | 1.744 |
| Viscosidade | 3.77 cP (244 °C) 3.04 cP (275 °C)[3] |
| Estrutura | |
| Estrutura cristalina | Ortorrômbica, oP56[5] |
| Grupo de espaço | P212121, No. 19[5] |
| Parâmetro de rede | a = 6.992(2) Å Å,b = 7.335(2) Å Å,c = 10.125(2) Å[5] Å |
| Parâmetro de rede | α = 90°, β = 90°, γ = 90° |
| Termoquímica | |
| Entalpia padrão de formação ΔfH |
−124.4 kJ/mol[1] |
| Entropia molar padrão S |
140.9 J/mol·K[1] |
| Capacidade calorífica molar Cp 298 |
93.1 J/mol·K[1] |
| Farmacologia | |
| Código ATC | D08 |
| Riscos associados | |
| Classificação UE | |
| Principais riscos associados |
Explosivamente reage com etanol. Corrosivo. |
| NFPA 704 |
 1
3
3
|
| Frases R | R8, R34, R35 |
| Frases S | S26, S36/37/39, S45, S60, S61 |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Características gerais
É um sal inorgânico, sólido à temperatura ambiente, de coloração esbranquiçada, sensível à luz. É venenoso e forte agente oxidante, a ponto de causar queimaduras por contato direto, e irritação por inalação ou contato com a pele, mucosas ou olho. É bastante solúvel em água, formando soluções incolores. Por ser forte oxidante, pode inflamar materiais combustíveis, e é explosivo quando misturado com materiais orgânicos ou outros materiais também oxidantes. A temperaturas elevadas, pode decompor-se com emissão de gases tóxicos. ((B&M))
Usos
É usado em fotografia convencional (fotoquímica, não digital), em eletrodeposição, na fabricação de vidros e espelhos, como germicida. Soluções fracas são usadas em tintas capilares e em anti-sépticos. Também se usa em Medicina, em alguns remédios, e em Química, para o desenvolvimento de novas substâncias. É empregado também na área de solução térmica, onde as pastas térmicas de alto desempenho possuem frações de nitrato de prata em sua composição. Mas também é usado como componente de artifício conhecido por estalinho, biribinha e traque de salão.
Em histologia, o nitrato de prata é utilizado como corante para comprovar a existência de fibras reticulares, ácidos nucleícos e proteínas (nomeadamente na eletroforese em gel de poliacrilamida- PAGE).
Cuidados no manuseio
- Acondicionar e manipular o produto por meio de uso de instrumental (recipientes, bastões e acessórios de laboratório químico) adequado, de preferência em vidros termorresistentes ou em sintéticos inertes (teflon etc.);
- Evitar contato com tecidos vivos (peles, mucosas, olhos etc.), ou de origem orgânica (algodões, papéis etc.);
- Afastar de produtos incompatíveis e/ou reativos;
- Afastar de fontes de calor e/ou de luz;
- Limites de tolerância:EL 0,1 mg/m³ (como Ag), DL50 1173 mg/kg, (trato-oral).
Incompatibilidade
Acetileno e seus compostos, hidróxido de amônio, água oxigenada, carbonato de cálcio, etanol, ácido nítrico com etanol, bromo-2-propano, carvão vegetal, trifluoreto de cloro e óxido de etileno.
Efeitos da exposição

- Inalação: Alto. Causa sensação de queima, tosse, dificuldade respiratória, laringite, cefaleia, náusea e vômito.
- Contato com olhos: Alto. Pode causar embaçamento da visão, vermelhidão, dor e queimadura severas dos tecidos com danos aos olhos.
- Contato com pele: Alto. Causa vermelhidão, queimaduras cutâneas severas e dor.
- Ingestão: Alto. Causa severas queimaduras na boca, garganta, estômago. Pode causar dores de garganta, vômito e diarreia, além de colapso, coma e morte.
Primeiros socorros
- Inalação: Remover para local arejado. Se respirar com dificuldade, ministrar oxigênio. Se cessar a respiração, aplicar respiração artificial.
- Contato com os olhos: Lavar imediatamente com muita água por, pelo menos, 15 minutos.
- Contato com a pele: Lavar imediatamente com água e sabão até que toda a substância seja removida da pele.
- Ingestão: Não provocar vômito, dando à vítima grande quantidade de água ou leite.
- Em qualquer um dos casos levar a vítima para o hospital imediatamente, pois pode levar a óbito, coma, convulsões e outros.
Ver também
Referências
- Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (90th ed.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds 2nd ed. New York: D. Van Nostrand Company. pp. 617–619
- Anatolievich, Kiper Ruslan. «silver nitrate». Chemister.ru. Consultado em 20 de julho de 2014
- "MSDS of Silver sulfate". Fisher Scientific, Inc. Fair Lawn, New Jersey. Consultado em 20 de julho de 2014.
- Meyer, P.; Rimsky, A.; Chevalier, R. (1978). "Structure du nitrate d'argent à pression et température ordinaires. Example de cristal parfait". Acta Crystallographica. 34 (5): 1457–1462
- Nitrato de prata ou "cáustico lunar" (Especificação CETESB)
- Bonato, op.cit..
- Bonato, op.cit.: utiliza-se-o como base para obtenção doutros nitratos.
Ligações externas
- «International Chemical Safety Card 1116.» (em inglês)
- «NIOSH Pocket Guide to Chemical Hazards.» (em inglês)
- Nitrato de prata no Guidechem.com
}