Diazometano
Diazometano é o composto químico de fórmula CH2N2. Na forma pura a temperatura ambiente, é um gás amarelo, mas é sempre universalmente usado como uma solução em éter dietílico. É um dos mais comuns compostos diazo. É também tóxico e potencialmente explosivo.[1][2]
| Diazometano Alerta sobre risco à saúde | |
|---|---|
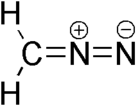 | |
 | |
| Nome IUPAC | Diazomethane |
| Identificadores | |
| Número CAS | |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | CH2N2 |
| Massa molar | 42.04 g/mol |
| Densidade | 1.4 (air=1) |
| Ponto de fusão |
-145 °C |
| Ponto de ebulição |
-23 °C |
| Estrutura | |
| Forma molecular | linear C=N=N |
| Momento dipolar | polar |
| Riscos associados | |
| Principais riscos associados |
tóxico e explosivo |
| Frases R | R12 R19 R22 R66 R67 |
| Frases S | S9 S16 S29 S33 |
| Compostos relacionados | |
| grupos funcionais relacionados | Azidas (R-N=N=N) Azo-compostos (R-N=N-R) |
| Compostos relacionados | Diazoacetato de etila Diazonitrofenol |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Preparação[3]
CH2N2 é usualmente preparado como uma solução em éter dietílico e usado para converter ácidos carboxílicos em seus ésteres metílicos ou seus homólogos (ver síntese de Arndt-Eistert). Na reação de Buchner-Curtius-Schlotterbeck (1885) diazometano reage com um aldeído para formar cetonas. Diazometano é também frequentemente usado como um equivalente de carbeno. Diazometano é preparado em laboratório na escala de mmol de precursores tais como Diazald ou N-metil-N-nitroso-p-toluenessulfonamida e MNNG ou 1-metil-3-nitro-1-nitrosoguanidina. Diazald em uma solução de diglima e éter dietílico reage com uma solução morna de hidróxido de sódio e o CH2N2 gerado é coletado por destilação. Diazometano é liberado de uma solução em éter dietílico pela adição de hidróxido de potássio aquoso a baixas temperaturas.
CH2N2 reage com soluções básicas de 2H2O para dar o derivado deuterado C2H2N2.[4]
Ensaio
A concentração de CH2N2 pode ser determinada em qualquer de dois ensaios convenientes. Ele pode ser tratado com um excesso de ácido benzoico em Et2O frio. O ácido benzoico não reagido é então testado usando titulação com NaOH padrão. Alternativamente, a concentração de CH2N2 em Et2O pode ser determinada espectrofotometricamente a 410 nm onde seu coeficiente de extinção, ε, é 7.2.
Outros compostos diazometânicos
Muitos derivados substituídos de diazometano tem sido preparados:
Referências
- J. A. Moore; D. E. Reed “Diazomethane” Organic Syntheses Collective Volume 5, p. 351
- P. G. Gassman e W. J. Greenlee “Dideuterodiazomethane” Organic Syntheses Collective Volume 6, p. 432.
- J. A. Moore; D. E. Reed “Diazomethane” Organic Syntheses Collective Volume 5, page 351
- P. G. Gassman and W. J. Greenlee “Dideuterodiazomethane” Organic Syntheses Collective Volume 6, page 432.
- W. J. Middleton; D. M. Gale “Bis(Trifluoromethyl))diazomethane” Organic Syntheses Collective Volume 6, page 161
- L. I. Smith, K. L. Howard “Diphenyldiazomethane” Organic Syntheses Collective Volume 3, page 351
- T. Shioiri, T. Aoyama, S. Mori “Trimethylsilyldiazomethane” Organic Syntheses Collected Volume, Volume 8, page 612.
- X. Creary “Tosylhydrazone Salt Pyrolyses: Phenydiazomethanes” Organic Syntheses, Coll. Vol. 7, p.438 (1990); Vol. 64, p.207 (1986).