Iodometano
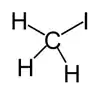
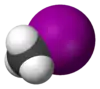
Iodometano, comumente chamado iodeto de metila e comumente abreviado "MeI", é um composto químico com a fórmula CH3I. Este líquido denso e volátil é relacionado ao metano por substituição de um átomo de hidrogênio por um átomo de iodo e seu momento dipolar é 1.59 D. Índice de refração de 1.5304 (20 °C, D), 1.5293 (21 °C, D). É miscível com solventes orgânicos comuns. É incolor, embora se exposto a luz, amostras desenvolvem uma cor púrpura causada pela presença de I2. Estocagem em cobre absorve o iodo. O iodeto de metila é largamente usado em síntese orgânica como fonte do grupo metila, via a transformação chamada metilação. É naturalmente emitido por plantações de arroz em pequenas quantidades.[4]
| Iodometano Alerta sobre risco à saúde | |
|---|---|
 |
 |
| Nome IUPAC | Iodometano |
| Outros nomes | Iodeto de metila, monoiodometano, metil-iodo, MeI, Halon 10001, UN 2644 |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| Número RTECS | PA9450000 |
| SMILES |
|
| InChI | 1/CH3I/c1-2/h1H3 |
| Propriedades | |
| Fórmula molecular | CH3I |
| Massa molar | 141.94 g/mol |
| Aparência | Líquido incolor com odor acre |
| Densidade | 2,27 g·cm-3[1] |
| Ponto de fusão |
-66 °C[1] |
| Ponto de ebulição |
42 °C[1] |
| Solubilidade em água | praticamente insolúvel (14 g·l-1 a 20 °C)[1] |
| log P | 1.51 [carece de fontes] |
| Pressão de vapor | 441 hPa (20 °C)[1] |
| Índice de refracção (nD) | 1,5304[2] |
| Estrutura | |
| Forma molecular | Tetraédrica |
| Termoquímica | |
| Entalpia padrão de formação ΔfH |
-13,6 ± 0,5 kJ·mol-1[3] |
| Riscos associados | |
| Classificação UE | Tóxico (T), Carc. Cat. 3 |
| NFPA 704 |
 1
3
1
|
| Frases R | R21, R23, R25, R37, R38, R40 |
| Frases S | S1, S2, S36, S37, S38
, S45 |
| Ponto de fulgor | -28 °C |
| Temperatura de auto-ignição |
352 °C |
| Limites de explosividade | 8.5 - 66% |
| LD50 | 76 mg·kg-1 (rato, per os)[2] |
| Compostos relacionados | |
| Halometanos relacionados | Fluormetano Clorometano Bromometano Diiodometano Iodofórmio (triiodometano) Tetraiodometano |
| Compostos relacionados | Iodeto de etila Carbonato de dimetila (reagente de metilação) Sulfato de dimetila (reagente de metilação) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Propriedades químicas
Iodeto de metila é um excelente substrato para as reações de substituição SN2. Sua estericalidade aberta ao ataque por nucleófilos, e iodo é um bom grupo lábil. Por exemplo, pode ser usado para a metilação de fenóis ou ácidos carboxílicos:[5]
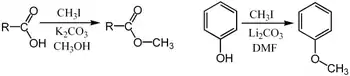
Nestes exemplos, as bases (K2CO3 ou Li2CO3) remove o próton ácido para formar o ânion carboxilato ou fenóxido, o qual serve como um nucleófilo na substituição SN2.
Iodeto é um ânion "macio" o que significa que a metilação com MeI tende a ocorrer na terminação "mais macia" de um múltiplo nucleófilo. Por exemplo, reação com íon tiocianato favorece o ataque no enxofre preferencialmente que o "duro" nitrogênio, conduzindo normalmente a tiocianato de metila (CH3SCN) mais que CH3NCS. Este comportamento é relevante para a metilação de enolatos estabilizados os quais derivam dos compostos de 1,3-dicarbonila. Metilação destes e enolatos relacionados podem ocorrer no átomo mais "duro" oxigênio ou o (usualmente desejado) átomo de carbono. Com iodeto de metila, C-alquilação normalmente sempre predominará.
MeI é também um importante precursor do iodeto de metilmagnésio ou "MeMgI", o qual é um reagente usual. Porque o MeMgI forma-se prontamente, ele é frequentemente preparado em laboratórios de instituições de ensino como uma ilustração do reagente de Grignard. O uso do MeMgI tem sido substituído crescentemente pelo comercialmente disponível metil-lítio.
No processo Monsanto, MeI forma in situ da reação do metanol e iodeto de hidrogênio. O CH3I então reage com monóxido de carbono na presença de um complexo de ródio para formar iodeto de acetila, o precursor do ácido acético após hidrólise. Muito ácido acético é preparado deste modo.
MeI hidrolisa a 270 °C formando iodeto de hidrogênio, monóxido de carbono e dióxido de carbono.
Preparação
Iodometano é formado via a reação exotérmica que ocorre quando iodo é adicionado a uma mistura de metanol com fósforo vermelho:[6]
O reagente de iodação é o triiodeto de fósforo que é formado in situ. Alternativamente, é preparado pela reação de dimetilsulfato com iodeto de potássio em presença de carbonato de cálcio:[6]
- (CH3O)2SO2 + KI → K2SO4 + 2 CH3I
O CH3I pode facilmente ser purificado por destilação seguida por lavagem com Na2S2O3 (para remover o iodo) e então água, e Na2CO3 aq..
Iodeto de metila póde ser formado durante acidentes nucleares pela reação de matéria orgânica com o "iodo de fissão".
Escolha do iodometano como agente de metilação
Iodometano é um excelente reagente para metilação, mas há algumas desvantagens no seu uso. Ele tem um lto peso equivalente: um mole de MeI pesa quase três vezes quanto um único mole de cloreto de metila. Entretanto, o cloreto é um gás (como é o brometo de metila), fazendo-o mais difícil de se trabalhar que o MeI, líquido. Colreto de metila é um mais pobre agente de metilação que MeI, mas é frequentemente adequado.
Iodetos são geralmente mais caros relativamente aos mais comuns cloretos e brometos, embora o iodometano seja razoavelmente acessível; numa escala comercial, o tóxico sulfato de dimetila é preferido, já que é barato e líquido. O iodo que deixa o grupo em MeI pode causar reações colaterais, como é um poderoso nucleófilo. Finalmente, sendo altamente reativo, MeI é mais perigoso para trabalhadores em laboratório que os cloretos e brometos. Quando consideramos alternativas ao MeI, é necessário considerar custo, manuseio, riscos, seletividade química, e a facilidade de reação.
Usos
Além do uso como um agente de metilação. tem sido proposto seu uso como fungicida, herbicida, inseticida ou nematicida e como um extintor de incêndio. Além disso pode ser usado como um desinfetante de solos, substituindo o bromometano (o qual tem sido banido pelo Protocolo de Montreal), e em microscopia devido a suas propriedades relacionadas ao índice de refração. Em uma decisão controversa em outubro de 2007, a United States Environmental Protection Agency aprovou seu uso como um fumigante de solo em alguns casos, empora não possa ainda ser usado na Califórnia (um mercado de maior potencial) devido a falta de aprovação estadual.[7]
Efeitos biológicos
Iodometano tem LD50 para administração oral em ratos de 76 mg/kg e no fígado ele sofre rápida conversão a S-metilglutationa.[8]
Respirar vapores de iodometano pode causar danos nos pulmões, fígado, rins e sistema nervoso central. Causa náusea, vertigens, tosse e vômito. Contato prolongado com a pele causa queimaduras. Inalação massiva causa edema pulmonar.
Referências
- Registo de CAS RN 74-88-4 na Base de Dados de Substâncias GESTIS do IFA, accessado em 13 de Janeiro de 2008.
- Thieme Chemistry, ed. (2009). RÖMPP Online - Version 3.5. Stuttgart: Georg Thieme Verlag KG
- A. S. Carson, P. G. Laye, J. B. Pedley, Alison M. Welsby: The enthalpies of formation of iodomethane, diiodomethane, triiodomethane, and tetraiodomethane by rotating combustion calorimetry, in: The Journal of Chemical Thermodynamics, 1993, 25 (2), S. 261–269; doi:10.1006/jcht.1993.1025.
- K. R. Redeker, N.-Y. Wang, J. C. Low, A. McMillan, S. C. Tyler, and R. J. Cicerone (2000). «Emissions of Methyl Halides and Methane from Rice Paddies». Science. 290: 966-969. doi:10.1126/science.290.5493.966
- Avila-Zárraga, J. G., Martínez, R. (janeiro de 2001). «Efficient methylation of carboxylic acids with potassium hydroxide/methyl sulfoxide and iodomethane». Synthetic Communications. 31 (14): 2177 - 2183. doi:10.1081/SCC-100104469
- King, C. S.; Hartman, W. W. (1943). «Methyl Iodide». Org. Synth.; Coll. Vol., 2
- «EPA approves new pesticide despite scientists' concerns». Los Angeles Times. 6 Outubro 2007
- Johnson, M. K. (1966). «Metabolism of iodomethane in the rat». Biochem. J. 98: 38-43
- Sulikowski, G. A.; Sulikowski, M. M. (1999). in Coates, R.M.; Denmark, S. E. (Eds.) Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation New York: Wiley, pp. 423–26.
- Bolt H. M., Gansewendt B. (1993). «Mechanisms of carcinogenicity of methyl halides.». Crit Rev Toxicol. 23 (3): 237-53
Ligações externas
- Pocket Guide to Chemical Hazards 0509 (em inglês)
- International Chemical Safety Card 0420 (em inglês)
- International Chemical Safety Card 0509 (em inglês)
- Omkar Speciality Chemicals Pvt Ltd. (em inglês)
- IARC Summaries & Evaluations: Vol. 15 (1977), Vol. 41 (1986), Vol. 71 (1999) (em inglês)
- MSDS na Oxford University (em inglês)
- MSDS do iodometano-d3 na Oxford University (em inglês)
- Metabolismo do iodometano em ratos (em inglês)
- Espectro NMR do iodometano (em inglês)