Tetracloreto de titânio
Tetracloreto de titânio ou cloreto de titânio (IV) é o composto inorgânico com a fórmula TiCl4. É um importante intermediário na produção do metal titânio e do pigmento dióxido de titânio.
| Tetracloreto de titânio Alerta sobre risco à saúde | |
|---|---|
 | |
 | |
| Nome IUPAC | Titanium tetrachloride Titanium(IV) chloride |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| Número RTECS | XR1925000 |
| Propriedades | |
| Fórmula molecular | TiCl4 |
| Massa molar | 189.71 g/mol |
| Aparência | líquido incolor fumegante |
| Densidade | 1.726 g/cm3 |
| Ponto de fusão |
-24.8 °C |
| Ponto de ebulição |
136.4 °C |
| Solubilidade em água | reage formando TiO2 e HCl |
| Solubilidade | solúvel em etanol |
| Viscosidade | 8.27 x 10-4 Pa s |
| Estrutura | |
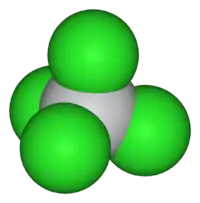
| Forma molecular | Tetraédrico |
| Momento dipolar | zero |
| Termoquímica | |
| Entalpia padrão de formação ΔfH |
-804.16 kJ/mol |
| Entropia molar padrão S |
221.93 J K−1 mol−1 |
| Riscos associados | |
| MSDS | ICSC 1230 |
| Classificação UE | Corrosivo (C) |
| Índice UE | 022-001-00-5 |
| NFPA 704 |
 0
3
2
|
| Frases R | R14, R34 |
| Frases S | S1/2, S7/8, S26, S36/37/39, S45 |
| Ponto de fulgor | Não inflamável |
| Compostos relacionados | |
| Outros aniões/ânions | Fluoreto de titânio(IV) Brometo de titânio(IV) Iodeto de titânio(IV) |
| Outros catiões/cátions | Cloreto de zircônio(IV) Cloreto de háfnio(IV) |
| Compostos relacionados | Cloreto de titânio(II) Cloreto de titânio(III) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
TiCl4 é um exemplo incomum de um haleto metálico que é altamente volátil. Em contato com a humidade do ar, ele forma "cortinas de fumaça" muito densas de Dióxido de titânio (TiO2) e Ácido clorídrico (HCℓ).[1]-->
Aplicações
Produção do metal Titânio
A produção mundial de Titânio é da ordem de 4 Milhões de toneladas / ano, e é feito de TiCl4, usando o Processo Kroll.
- 2 Mg + TiCl4 → 2 MgCl2 + Ti
Produção de dióxido de titânio
Cerca de 90% da produção de TiCl4, é usado para fazer o pigmento Dióxido de titânio, envolvendo o processo de hidrólise.[2]
- TiCl4 + 2 H2O → TiO2 + 4 HCl
Cortinas de fumaça
O Tetracloreto de titânio, também tem sido usado para produzir "cortinas de fumaça" para uso militar, pois gera uma fumaça branca com baixa tendência à dissipação.[3]
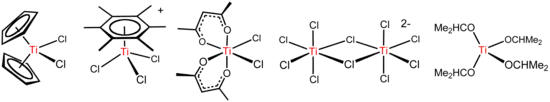
Reações químicas
O Tetracloreto de titânio, é um reagente versátil que forma vários outros compostos, incluindo os ilustrados abaixo.
Ver também
Referências
- American Chemistry
- Hans G. Völz et al. “Pigments, Inorganic” in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2006. doi:10.1002/14356007.a20_243.pub2
- The Royal Navy at War (DVD). London: Imperial War Museum. 2005