Cloreto de vanádio(IV)
Cloreto de vanádio(IV) ou Tetracloreto de vanádio é um composto químico inorgânico de fórmula VCl4. Em condições normais de temperatura e pressão, apresenta-se na forma de um líquido de coloração vermelho intenso. É um reagente bastante útil na preparação de outros compostos de vanádio.
| Vanadium tetrachloride Alerta sobre risco à saúde | |
|---|---|
 | |
| Nome IUPAC | Tetracloreto de vanádio Cloreto de vanádio(IV) |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| ChemSpider | |
| Número RTECS | YW2625000 |
| SMILES |
|
| InChI | 1/4ClH.2V/h4*1H;;/q;;;;2*+2/p-4 |
| Propriedades | |
| Fórmula molecular | VCl4 |
| Massa molar | 192.75 g/mol |
| Aparência | bright red liquid, moisture sensitive |
| Odor | pungent |
| Densidade | 1.816 g/cm3, liquid |
| Ponto de fusão |
−24.5 °C, 249 K, -12 °F |
| Ponto de ebulição |
148 °C, 421 K, 298 °F |
| Solubilidade em água | decomposes |
| Solubilidade | soluble in ether, ethanol |
| Pressão de vapor | 7.9 Pa |
| Estrutura | |
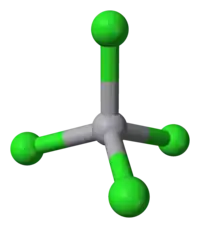
| Geometria de coordenação |
tetrahedral |
| Momento dipolar | 0 D |
| Riscos associados | |
| Índice UE | Not listed |
| Principais riscos associados |
oxidizer; hydrolyzes to release HCl |
| NFPA 704 |
 0
3
2
|
| LD50 | 160 mg/kg (rat, oral) |
| Compostos relacionados | |
| Outros aniões/ânions | Fluoreto de vanádio(IV), Dissulfeto de vanádio, Brometo de vanádio(IV) |
| Outros catiões/cátions | Cloreto de titânio(IV), Cloreto de crômio(V), Cloreto de nióbio(IV), Cloreto de tálio(IV) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Síntese e propriedades básicas
Com um elétron de valência a mais do que o composto diamagnético TiCl4, o VCl4 é um líquido paramagnético. Esse é um dos poucos compostos líquidos paramagnéticos que nas CNTP.
Tetracloreto de vanádio é preparado pela cloração do vanádio metálico. VCl5 não é formado no processo pois o Cl2 não possui força suficiente para atacar o VCl4. Em contraste, os análogos mais pesados NbCl5 and TaCl5 e não formam agente oxidantes.
Aplicações
VCl4 é um catalisador para polimerização de alcenos, particularmente útil na indústria da borracha. Uma tecnologia subjacente é relacionada à catálise Ziegler-Natta, que envolvem alquilas de vanádio como compostos intermediários.
Segurança
VCl4 é volátil, oxidante forte e que hidrolisa rapidamente em água formando HCl.
Referências
- Calderazzo, F.; Maichle-Mossmer, C.; Pampaloni, G. and Strähle, J. (1993). «Low-temperature Syntheses of Vanadium(III) and Molybdenum(IV) Bromides by Halide Exchange». Dalton Transactions: 655–8. doi:10.1039/DT9930000655