Ácido 3,4-di-hidroximandélico
Ácido 3,4-diidroximandélico (abreviado na literatura como DHMA, DOMA, do inglês 3,4-dihydroxymandelic acid) é um metabólito menor da norepinefrina.[1][2]
| Ácido 3,4-di-hidroximandélico Alerta sobre risco à saúde | |
|---|---|
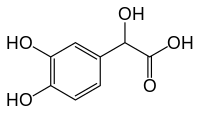 | |
| Nome IUPAC | 2-(3,4-dihydroxyphenyl)-2-hydroxyacetic acid |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| KEGG | |
| MeSH | |
| ChEBI | |
| SMILES |
|
| InChI | 1/C8H8O5/c9-5-2-1-4(3-6(5)10)7(11)8(12)13/h1-3,7,9-11H,(H,12,13) |
| Propriedades | |
| Fórmula molecular | C8H8O5 |
| Massa molar | 184.14612 |
| Compostos relacionados | |
| Outros aniões/ânions | Ácido vanilmandélico (3-hidroxi- substituído por metoxi-) 3,4-Diidroxifenilglicina (aminoácido) |
| Derivados do ácido glicólico relacionados | Ácido 3-hidroxifenilglicólico Ácido 4-hidroxifenilglicólico |
| Compostos relacionados | Ácido 3,4-diidroxifenilacético (DOPAC, alfa-hidroxila reduzida a -H) Diidroxifeniletilenoglicol (DOPEG, ácido duplamente reduzido a álcool) Ácido 3-(3,4-diidroxifenil)láctico (homólogo) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
O ânion do ácido 3,4-di-hidroximandélico, a base conjugada, é o 3,4-di-hidroximandelato.[3]
Ácido 3,4-diidroximandélico é um ácido 2-hidroximonocarboxílico e um membro dos catecóis que é o derivado 3,4-di-hidroxi do ácido mandélico; um metabólito de L-dopa. Tem um papel como antioxidante, metabólito de drogas, metabólito humano e metabólito de camundongo.[4]
Pacientes com neuroblastoma apresentam níveis elevados de ácido 3,4-diidroximandélico e outros metabólitos das catecolaminas, e sua presença na urina é um bom indicador para diagnóstico e acompanhamento.[5]
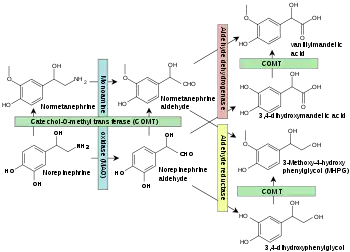
Nos nervos simpáticos, o aldeído produzido a partir da noradrenalina (norepinefrina) é convertido em 3,4-di-hidroxifenilglicol, e não no ácido 3,4-di-hidroximandélico. Consequentemente, a O-metilação extraneuronal subsequente conduz à produção de 3-metoxi-4-hidroxifenilglicol, não ácido vanilmandélico.[6]
Referências
- Ley JP, Engelhart K, Bernhardt J, Bertram HJ (outubro de 2002). «3,4-Dihydroxymandelic acid, a noradrenalin metabolite with powerful antioxidative potential». J. Agric. Food Chem. 50 (21): 5897–902. PMID 12358456. doi:10.1021/jf025667e
- Goldstein DS, Eisenhofer G, Kopin IJ. Sources and significance of plasma levels of catechols and their metabolites in humans. J Pharmacol Exp Ther. 2003 Jun;305(3):800-11.
- CHEBI:53326 - 3,4-dihydroxymandelate - ChEBI
- ChEBI - CHEBI:27637 - 3,4-dihydroxymandelic acid
- O'Meara A, Tormey W, FitzGerald RJ, Fitzgibbon M, Kenny D. Interpretation of random urinary catecholamines and their metabolites in neuroblastoma. Acta Paediatr. 1994 Jan;83(1):88-92.
- Eisenhofer, Graeme & Kopin, Irwin & Goldstein, David. (2004). Catecholamine Metabolism: A Contemporary View with Implications for Physiology and Medicine. Pharmacological reviews. 56. 331-49. 10.1124/pr.56.3.1.
- Figure 11-4 in: Rod Flower; Humphrey P. Rang; Maureen M. Dale; Ritter, James M. (2007). Rang & Dale's pharmacology. Edinburgh: Churchill Livingstone. ISBN 0-443-06911-5
Ver também
- Ácido vanilmandélico, metabólito terminal das catecolaminas (dopamina, epinefrina e norepinefrina).