Clorito de sódio
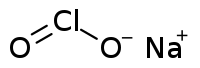
O clorito de sódio é um composto químico de fórmula química NaClO2.
| Clorito de sódio Alerta sobre risco à saúde | |
|---|---|
 | |
| Nome IUPAC | Sodium chlorite |
| Outros nomes | Clorato (III) de sódio |
| Identificadores | |
| Número CAS | |
| Número RTECS | VZ4800000 |
| Propriedades | |
| Fórmula molecular | NaClO2 |
| Massa molar | 90.44 g.mol-1 |
| Aparência | sólido branco |
| Densidade | 2.5 g/cm3, sólido |
| Ponto de fusão |
180–200 °C decomp. |
| Solubilidade em água | 39 g/100 ml (17 °C) |
| Riscos associados | |
| Classificação UE | not listed |
| NFPA 704 |
 0
1
1
OX
|
| Ponto de fulgor | não inflamável |
| Compostos relacionados | |
| Outros aniões/ânions | Cloreto de sódio Hipoclorito de sódio Clorato de sódio Perclorato de sódio |
| Outros catiões/cátions | Clorito de potássio Clorito de bário |
| Compostos relacionados | Dióxido de cloro Ácido cloroso |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Aplicações
A principal aplicação do clorito de sódio é o branqueamento e descascar de fibras têxteis, polpa de celulose e papel. É também usado para desinfecção de algumas instalações públicas de água após a conversão a dióxido de cloro. Uma vantagem nesta aplicação, em comparação a mais usual pelo cloro, é que trihalometanos não são produzidos dos contaminantes orgânicos. Clorito de sódio, também encontra aplicação como um componente em rinses terapêuticos, anti-sépticos bucais, cremes e géis dentais, sprays e pastilhas bucais, gomas de mascar "cloradas", e também em soluções para a limpeza de lentes de contato sob a nome comercial de purite.[1]
Obtenção
O clorito de sódio é derivado indiretamente do clorato de sódio, NaClO3. É obtido, primeiramente, pela obtenção do explosivamente instável gás dióxido de cloro, ClO2 que é produzido pela redução de clorato de sódio em um ácido forte com um agente redutor apropriado (por exemplo, cloreto de sódio, dióxido de enxofre, ou ácido clorídrico). O dióxido de cloro é então absorvido com uma solução alcalina, de hidróxido de sódio, tendo também como produto esta reação, o clorato de sódio (NaClO3):
Também pode ser obtido com a reação dos mesmos reagentes da reação anterior, com o acréscimo do peróxido de hidrogênio (H2O2) como agente redutor:[2]
Observação: Os correspondentes sais de metais pesados (Ag+, Hg+, Tl+, Pb2+, e também Cu2+ e NH4+) decompõe-se explosivamente com calor ou choque.
Referências
- «ACIDIFIED SODIUM CHLORITE (ASC) Chemical and Technical Assessment» (PDF)
- Holleman, Wiberg, Lehrbuch der Anorganischen Chemie, deGruyter Verlag, 101. Auflage, S. 477 (em alemão)