Ácido fluorossulfúrico
Ácido fluorossulfúrico é considerado um superácido e é formado pela reação do trióxido de enxofre - SO3 - com o ácido fluorídrico. É um dos mais fortes ácidos comercialmente disponíveis.[1]
| Fluorosulfuric acid Alerta sobre risco à saúde | |
|---|---|
 | |
 | |
| Nome IUPAC | Sulfurofluoridic acid |
| Outros nomes | Fluorosulfonic acid |
| Identificadores | |
| Número CAS | |
| Número EINECS | |
| Número RTECS | LP0715000 |
| Propriedades | |
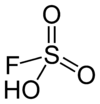
| Fórmula molecular | FSO3H |
| Massa molar | 100.06 g/mol |
| Aparência | Colorless liquid |
| Densidade | 1.84 g/cm3, liquid |
| Ponto de fusão |
−87.3 °C |
| Ponto de ebulição |
165.5 °C |
| Solubilidade em água | Soluble |
| Acidez (pKa) | −10 |
| Estrutura | |
| Forma molecular | tetrahedral |
| Momento dipolar | N/A |
| Riscos associados | |
| MSDS | ICSC 0996 |
| Classificação UE | Harmful (Xn) Corrosive (C) Oxidant(O) |
| Índice UE | 016-018-00-7 |
| Frases R | R20, R35,R8,R5 |
| Frases S | S1/2, S26, S45 |
| Compostos relacionados | |
| Outros aniões/ânions | Ácido clorossulfúrico Fluoreto de sulfurila |
| Ácidos relacionados | Ácido sulfúrico Ácido trifluorometanossulfônico Ácido fluorídrico |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Propriedades químicas
O ácido fluorossulfónico é um líquido incolor de baixa viscosidade. É solúvel em solventes orgânicos polares (entre outros o nitrobenzeno , ácido acético e acetato de etilo ), mas é pouco solúvel em solventes não polares, tais como alcanos. Apresente elevada acidez, e é solúvel quase em todos os compostos orgânicos, mesmo aqueles que são fracos receptores de prótons..[2] O FSO 3 H é hidrolisado lentamente para HF e ácido sulfúrico. O ácido tríflico CF 3 SO 3 H, que está relacionada com ele, retém a acidez elevada da FSO 3 H mas é hidroliticamente estável.
- 2 HSO3F
 [H2SO3F]+ + [SO3F]− K = 4.0 × 10−8 (at 298 K)
[H2SO3F]+ + [SO3F]− K = 4.0 × 10−8 (at 298 K)
Produção
O ácido fluorossulfónico é preparado pela reação de HF com óxido de enxofre (VI) : SO 3 + HF → FSO 3 H. Alternativamente, KHF2 ou CaF2 podem ser tratados com ácido sulfúrico fumante a 250 ° C. Uma vez libertado do HF por deslocamento com um gás inerte, de FSO3 H pode ser destilado num aparelho de vidro.[3]
- SO3 + HF → HSO3F
Segurança
O ácido fluorossulfónico é considerado altamente tóxico e corrosivo. Seu manuseio requer recipientes de PTFE ou níquel, pois o composto ataca o vidro e plásticos comuns.
Referências
- Christopher A. Reed "Myths about the Proton. The Nature of H+ in Condensed Media" Acc. Chem. Res., 2013, 46 (11), pp 2567–2575. doi:10.1021/ar400064q
- Encyclopedia of Reagents for Organic Synthesis 2001 John Wiley & Sons, Ltd
- Cotton, F. A.; Wilkinson, G. (1980). Advanced Inorganic Chemistry 4th ed. New York: Wiley. p. 246. ISBN 0-471-02775-8