Ácido selênico
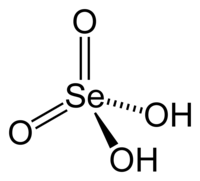
Ácido Selênico é um composto químico de fórmula H2SeO4. Foi descoberto em 1827 por Eilhard Mitscherlich.
| Ácido Selênico Alerta sobre risco à saúde | |
|---|---|
 | |
 | |
| Outros nomes | Ácido Selênico |
| Identificadores | |
| Número CAS | |
| ChemSpider | |
| Número RTECS | VS6575000 |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | H2SeO4 |
| Massa molar | 144.9734 g/mol |
| Aparência | Cristais incolores |
| Densidade | 2.95 g/cm3, sólido |
| Ponto de fusão |
58 °C (331 K) |
| Ponto de ebulição |
260 °C (533 K) |
| Solubilidade em água | 130 g/100 mL (30 °C) |
| Acidez (pKa) | similar ao H2SO4 |
| Índice de refracção (nD) | 1.5174 (D-line, 20 °C) |
| Estrutura | |
| Forma molecular | Tetraedro no Se |
| Riscos associados | |
| Principais riscos associados |
Corrosivo, altamente tóxico |
| NFPA 704 |
 0
3
2
|
| Frases R | 23/25-33-50/53 |
| Frases S | 20/21-28-45-60-61 |
| Compostos relacionados | |
| Outros aniões/ânions | Selenato |
| Outros catiões/cátions | íon selênio, SeO22+ |
| Oxiácidos relacionados | Ácido selenoso Ácido sulfúrico Àcido telúrico Ácido brômico Ácido arsênico |
| Compostos relacionados | Trióxido de selênio |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Preparação e reações
Ácido Selênico é preparado pela oxidação do dióxido de selênio com peróxido de hidrogênio:
- SeO2 + H2O2 → H2SeO4
Para obter o anidro,a solução resultante é evaporada a temperatura de <140 °C no vácuo.[1]
Como o ácido sulfúrico, o ácido selênico é um ácido forte que é higroscópico e extremamente solúvel em água. Soluções concentradas são viscosas.
Ácido Selênico reage com sais de bário para precipitar BaSeO4, análogo ao sulfato.
Ácido Selênico com ácido fluorsulfúrico gera o dioxidiflourato (b.p. -8.4C):[1]
- H2SeO4 + 2 HO3SF → SeO2F2 + 2 H2SO4
Ácido Selênico quente é capaz de dissolver ouro
- 2Au + 6H2SeO4 → Au2(SeO4)3 + 3H2SeO3 + 3H2O
Referências
- Seppelt, K. “Selenoyl difluoride” Inorganic Syntheses, 1980, volume XX, pp. 36-38. ISBN 0-471-07715-1. The report describes the synthesis of selenic acid.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.